Les électrolytes sont des composés chimiques qui, lorsque dissous dans l'eau, libèrent des ions. La libération de ces ions fait en sorte que cette solution devient conductrice d’électricité.
Une substance électrolytique est une substance qui, lorsqu’elle est en solution, laisse passer le courant électrique.
<!DOCTYPE html PUBLIC "-//W3C//DTD HTML 4.0 Transitional//EN" "http://www.w3.org/TR/REC-html40/loose.dtd">
<html><body><p>Si un soluté ionique est dissous dans l’eau, on assiste à une <a href="/fr/eleves/bv/sciences/la-dissolution-s1053"> dissolution ionique</a>.</p>
</body></html>
<!DOCTYPE html PUBLIC "-//W3C//DTD HTML 4.0 Transitional//EN" "http://www.w3.org/TR/REC-html40/loose.dtd">
<html><body><p><a href="/fr/eleves/bv/sciences/les-proprietes-et-formules-des-acides-des-bases-s1034">Les acides, les bases </a>et <a href="/fr/eleves/bv/sciences/les-proprietes-et-formules-des-acides-des-bases-s1034">les sels</a> sont les groupes de substances qui permettent le passage du courant électrique. Ce sont donc des substances électrolytiques.</p>
</body></html>

Une substance non électrolytique est une substance qui, lorsqu’elle est en solution, ne laisse pas passer le courant électrique.
<!DOCTYPE html PUBLIC "-//W3C//DTD HTML 4.0 Transitional//EN" "http://www.w3.org/TR/REC-html40/loose.dtd">
<html><body><p>C’est généralement un soluté covalent qui est dissous dans l’eau. On assiste à une <a href="/fr/eleves/bv/sciences/la-dissolution-s1053"> dissolution moléculaire</a>.</p>
</body></html>
Le sucre et l’alcool sont tous deux des substances non électrolytiques, car ni le sucre, ni l'alcool ne permettent le passage du courant électrique.
La conductibilité électrique peut se mesurer grâce à un détecteur de conductibilité électrique (DCE). Il suffit de plonger les électrodes du DCE dans la solution et de vérifier si les lumières du DCE s'allument.
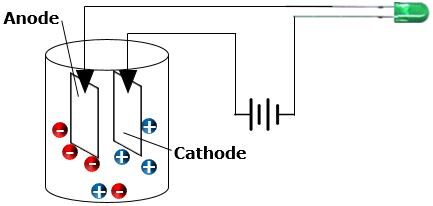
Le terme électrolytique fait référence à l’électricité. Il y a trois conditions qui doivent être réunies pour que le courant électrique puisse circuler dans une solution.
-
L’existence de charges électriques dans le soluté : une liaison ionique doit exister dans le composé.
-
La mobilité des charges électriques du soluté: le soluté ionique doit être en solution pour que les ions (les cations et les anions) puissent se déplacer.
-
L’orientation du mouvement des charges du soluté est à considérer. La présence d’électrodes est nécessaire. La cathode (électrode négative) provoque l’orientation des cations (charges positives) en les attirant vers elle. L’anode (électrode positive) provoque l’orientation des anions (charges négatives) en les attirant vers elle. Le déplacement des charges devient donc orienté en présence d’électrodes.
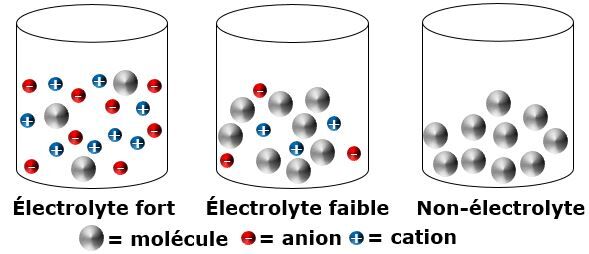
Plus une solution contient de charges électriques, plus elle sera conductrice d’électricité. Or, certains composés ioniques se dissolvent dans l’eau, mais leurs particules ne se séparent pas toutes en ions.
On assiste donc à un mélange de dissolution ionique et moléculaire. Selon le pourcentage de dissociation des particules en ions, le soluté pourrait alors être considéré comme un électrolyte fort ou un électrolyte faible.
| | Électrolyte fort | Électrolyte faible | Non-électrolyte |
| Dissociation | Les particules d’un électrolyte fort se sépareront dans un grand pourcentage en ions. | Les particules d’un électrolyte faible se sépareront dans un faible pourcentage en ions. | Les particules d'un non-électrolyte ne se sépareront pas en ions. |
| Présence de particules neutres et d'ions en solution | Beaucoup d’ions et peu de particules neutres seront présents dans la solution. | Peu d’ions et beaucoup de particules neutres seront présents dans la solution. | Il n'y aura que des particules neutres en solution. |
| Conductibilité électrique | Un électrolyte fort conduit très bien l’électricité. | Un électrolyte faible laissera plus difficilement circuler l’électricité. | Un non-électrolyte ne permet pas le passage du courant électrique. |
| Exemples | Sel de table |(NaCl)| Acide chlorhydrique |(HCl)| |
Vinaigre |(CH_{3}COOH)| Ammoniaque |(NH_{4}OH)| |
Sucre |(C_{6}H_{12}O_{6})| Méthanol |(CH_{3}OH)| |