Une réaction d'oxydoréduction est une réaction qui implique un échange d'électrons entre des réactifs.
De nombreuses transformations chimiques impliquent le transfert d'un ou de plusieurs électrons d'un atome à un autre. Ces réactions, qu'elles soient synthèse, décomposition, combustion ou photosynthèse, impliquent toutes deux réactions simultanées: l'oxydation et la réduction. Étant donné qu'une réaction d'oxydoréduction implique les deux réactions à la fois, on parlera de demi-réaction d'oxydation et de demi-réaction de réduction. Il est à noter que, malgré ce que son nom peut faire croire, la présence d'oxygène n'est pas une condition nécéssaire à l'oxydation. Le fonctionnement d'une pile électrochimique implique une réaction d'oxydoréduction.
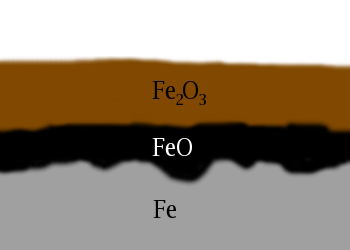
La formation de la rouille est un exemple d'oxydoréduction puisqu'elle entraîne un transfert d'électrons entre le fer et l'oxygène selon la réaction suivante:
|4 Fe_{(s)} + 3 O_{2(g)}| → |2 Fe_{2}O_{3(s)}|.
L'image de droite représente la couche de rouille qui s'installe en surface du fer suite au contact avec l'oxygène atmosphérique.
Lors d'une demi-réaction d'oxydation, un atome perd un ou plusieurs de ses électrons. À chaque fois qu'une substance donne un électron, sa charge ionique, qui correspond à son degré d'oxydation, augmente de 1.
Dans l'équation de cette demi-réaction, les électrons font toujours partie des produits; ils sont donc situés à la droite de la flèche de l'équation. La substance qui donne un ou des électrons, en l'occurrence le réactif de la réaction, est nommée l'agent réducteur. Cette substance peut aussi être appelée substance oxydée.
Voici quelques exemples de demi-réactions d'oxydation:
|Mg_{(s)} \rightarrow Mg^{2+}_{(aq)} + 2e^-|
|Cu^{1+}_{(aq)} \rightarrow Cu^{2+}_{(aq)} + 1e^-|
|Al_{(s)} \rightarrow Al^{3+}_{(aq)} + 3e^-|
Ainsi, dans les exemples proposés, le |Mg_{(s)}|, le |Cu^{1+}_{(aq)}| et le |Al_{(s)}| sont à la fois des agents réducteurs et des substances oxydées.
Le degré d'oxydation d'une particule (atome, molécule ou ion) correspond à une charge (fictive ou arbitraire) qu'aurait cet élément si la particule dans laquelle il se trouve était totalement ionique. Ainsi, par convention, tous les éléments à l'état atomique possèdent un degré d'oxydation correspondant à 0, comme |Mg_{(s)}|et |Al_{(s)}|dans les exemples précédents.
Selon la loi de la conservation de la matière, les électrons ne peuvent être ni perdus ni créés. Ainsi, un autre atome doit accepter les électrons provenant de la demi-réaction d'oxydation pour qu'elle puisse se produire.
Lors d'une demi-réaction de réduction, un atome gagne un ou plusieurs électrons. À chaque fois qu'une substance gagne ou accepte un électron, son degré d'oxydation diminue de 1.
Dans l'équation de cette demi-réaction, les électrons font toujours partis des réactifs; ils sont donc situés à la gauche de la flèche de l'équation. La substance qui accepte des électrons, en l'occurrence le réactifs de la réaction, est nommée l'agent oxydant. Cette substance peut aussi être appelée substance réduite.
Voici quelques exemples de demi-réactions de réduction:
|Fe^{3+}_{(aq)} + 1e^- \rightarrow Fe^{2+}_{(aq)}|
|Cu^{1+}_{(aq)} + 1e^- \rightarrow Cu_{(s)}|
|Al^{3+}_{(aq)} + 3e^- \rightarrow Al_{(s)}|
Ainsi, dans les exemples proposés, le |Fe^{3+}_{(aq)}|, le |Cu^{1+}_{(aq)}| et le |Al^{3+}_{(aq)}| sont à la fois des agents oxydants et des substances réduites.
Selon la loi de la conservation de la matière, les électrons ne peuvent être ni perdus ni créés. Ainsi, les électrons acceptés par atome lors de la demi-réaction de réduction doivent provenir d'un autre atome qui les a donnés lors d'une demi-réaction d'oxydation.
Un échange d'électrons entre des réactifs a toujours lieu dans une réaction d'oxydoréduction. Ainsi, le réactif qui gagne des électrons est nommé oxydant puisqu'il cause l'oxydation d'une autre substance. À l'inverse, le réactif qui perd des électrons est nommé réducteur puisqu'il cause la réduction de l'autre substance. Dans une réaction d'oxydoréduction, l'oxydant et le réducteur forme un couple lié par un échange d'électrons. Le tableau ci-dessous résume les caractéristiques des deux types d'acteurs impliqués dans une réaction d'oxydoréduction.
| Agent | Échange d'électrons | Demi-réaction | L'atome est... |
| Réducteur | Il perd des électrons. | Oxydation | Oxydé |
| Oxydant | Il gagne des électrons. | Réduction | Réduit |
Dans une réaction d'oxydoréduction, l'oxydant et le réducteur forme un couple lié par un échange d'électrons.
Pour obtenir l'équation globale de l'oxydoréduction, on additionne les deux demi-réactions, celle d'oxydation et celle de réduction. Par exemple, la réaction d'oxydoréduction entre de l'aluminium solide est des ions de cuivre en solution aqueuse implique les deux demi-réactions suivantes:
Équation d'oxydation: |Al_{(s)} \rightarrow Al^{3+}_{(aq)} + 3e^-|
Équation de réduction: |Cu^{1+}_{(aq)} + 1e^- \rightarrow Cu_{(s)}|
Avant de procéder à l'addition des demi-réactions, on doit vérifier si le nombre d'électrons donnés est égal au nombre d’électrons reçus. Dans l'exemple, l'aluminium porte une charge de 3+ après l'oxydation alors que l'ion cuivre porte une charge de 1+. On doit donc multiplier par 3 l'équation de réduction afin de s'assurer que ce nombre d'électrons soit égal autant dans les produits de la réaction d'oxydation que dans les réactifs de la réaction de réduction.
Après la multiplication par 3 de la réaction de réduction, on obtient les deux demi-réactions suivantes:
Équation d'oxydation: |Al_{(s)} \rightarrow Al^{3+}_{(aq)} + 3e^-|
Équation de réduction: |3 Cu^{1+}_{(aq)} + 3e^- \rightarrow 3 Cu_{(s)}|
On peut désormais additionner les deux équations. Il est important de remarquer que les trois électrons de chaque côté de la flèche s'annulent.
Équation globale d'oxydoréduction:
|Al_{(s)} + 3 Cu^{1+}_{(aq)} \rightarrow Al^{3+}_{(aq)} + 3 Cu_{(s)}|
Cette équation est équilibrée puisque la somme des charges (soit 0) est identique sur chacun des deux côtés du système.
Dans une équation d'oxydoréduction, il y a toujours un élément solide et un ion en phase aqueuse impliqués, autant dans les réactifs que dans les produits. De plus, le réactif solide devient un ion dans les produits alors que le réactif ionique devient un élément solide dans les produits.
Terminologie
En lien avec l'exemple ci-dessus, on peut résumer les principaux termes utilisés lors d'un phénomène d'oxydoréduction.
Demi-réaction d'oxydation: équation dans laquelle les électrons sont à la droite de la flèche de la réaction; il s'agit de la réaction impliquant l'aluminium solide dans l'exemple.
Demi-réaction de réduction: équation dans laquelle les électrons sont à la gauche de la flèche de la réaction; il s'agit de la réaction impliquant les ions cuivre dans l'exemple.
Agent réducteur: c'est le donneur d'électrons; il s'agit de l'aluminium solide dans l'exemple. L'agent réducteur augmente son degré d'oxydation et on qualifie la substance d'oxydée.
Agent oxydant: c'est l'accepteur d'électrons; il s'agit de l'ion cuivre dans l'exemple. L'agent oxydant réduit son degré d'oxydation et on qualifie la substance de réduite.
Le nombre d'oxydation, aussi nommé degré d'oxydation, correspond à la charge relative d'un atome. Il indique le nombre d'électrons gagnés ou perdus lors de la réaction d'oxydoréduction.
Le nombre d'oxydation est toujours un nombre entier. Par convention, tous les éléments dans leur état fondamental ont un nombre d'oxydation de 0. Il acquiert une valeur positive lors d'une perte d'électrons alors qu'il devient négatif lors d'un gain d'électrons. Ainsi, le nombre d'oxydation augmente au moment d'une oxydation et, inversement, il diminue lors d'une réduction. La somme des nombre d'oxydation des atomes qui composent une molécule est égale à zéro. Si elle n'est pas nulle, nous sommes plutôt en présence d'un ion polyatomique.
Certaines règles permettent d'établir le nombre d'oxydation d'un atome:
- Le nombre d'oxydation d'un élément simple est de 0.
- Le nombre d'oxydation d'un ion monoatomique correspond à la charge de l'ion.
- Le nombre d'oxydation de l'oxygène est de -2 sauf dans le cas d'un peroxyde où il est de -1.
- Le nombre d'oxydation de l'hydrogène est généralement de +1, sauf dans les cas où l'hydrogène est lié uniquement à un métal (il est alors de -1).
- Le nombre d'oxydation d'un métal est toujours positif alors que celui d'un non-métal peut être positif ou négatif.
- Le nombre d'oxydation le plus probable d'un élément dépend du nombre d'électrons de valence de la famille à laquelle l'élément appartient.
- La somme des nombres d'oxydation d'une molécule est égale à zéro.
- La somme des nombres d'oxydation d'un ion polyatomique est égale à la charge de cet ion.
Le potentiel de réduction, ou E°, est la capacité relative d'un élément à accepter des électrons. Il est évalué par comparaison à l'ion |H^{+}_{(aq)}| dans la demi-réaction de réduction suivante: |2 H^+_{(aq)} + 2 e^- \rightleftharpoons H_{2(g)}|.
Chaque élément à l'état d'ion, d'atome ou de molécule possède une certaine capacité à recevoir des électrons. Le potentiel que possède un élément afin de recevoir un ou plusieurs électrons est évalué en volts (V). On a fixé de façon arbitraire la valeur de l'hydrogène à 0,00 V. Tous les éléments qui sont des meilleurs accepteurs d'électrons (ou de meilleurs oxydants) que le |H^{+}_{(aq)}| posséderont un potentiel de réduction supérieur à celui de l'hydrogène (Eº > 0,00 V). Au contraire, tous ceux qui sont plus faibles posséderont un potentiel de réduction inférieur à celui de l'hydrogène (Eº < 0,00 V).
En effectuant les recherches à une température de 25ºC, à une pression de 101,3 kPa et avec des solutions ioniques d'une concentration de 1 mol/L, on a déterminé les potentiels standard de réduction pour de nombreuses substances. Certaines sont listées dans le lien suivant:
Le potentiel standard de réduction
Le pouvoir réducteur d'un métal définit sa tendance à vouloir donner ses électrons et à s'oxyder.
Une réaction oxydoréduction spontanée survient lorsque celle-ci s'effectue naturellement, sans l'apport d'une forme d'énergie extérieure.
La tendance à donner des électrons varie d'un métal à l'autre. En général, les alcalins et les alcalino-terreux sont considérés comme de bons donneurs. Il est possible de classer les métaux selon leur pouvoir réducteur.
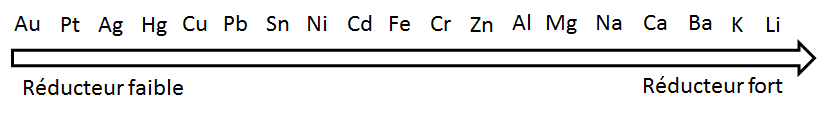
À l'aide de ce classement, on pourra prédire si une réaction se fait spontanément ou si elle nécessite un apport d'énergie. Pour qu'une réaction spontanée d'oxydoréduction se produise entre deux métaux, il faut que le réducteur le plus fort soit à l'état solide et que le plus faible soit sous forme d'ions en milieu aqueux. Les conditions nécessaires au déroulement d'une réaction spontanée sont donc les suivantes:
| Réaction | Réducteur le plus fort | Réducteur le plus faible |
| Spontanée | Solide | Solution aqueuse |
| Aucune | Solution aqueuse | Solide |
Ainsi, de l'aluminium solide en présence d'ions cuivre produirait une réaction spontanée tandis que l'inverse, du cuivre solide en présence d'ions d'aluminium, nécessiterait un apport d'énergie pour pouvoir se dérouler.
On peut aussi vérifier la possibilité d'une réaction spontanée en additionnant les valeurs des potentiels de rédution Eº des deux demi-réactions impliquant les réactifs.
- Si la valeur de l'énergie totale (Eº) est positive, la réaction sera alors spontanée.
- Dans le cas contraire (≤ 0,00 V), la réaction ne sera pas possible, car c'est la réaction inverse qui sera favorisée.
La compréhension de la spontanéité d’une réaction est fondamentale en chimie, car elle est la base du fonctionnement des piles électrochimiques.
Est-il possible de conserver une solution de |Cu^{2+}_{(aq)}| dans un récipient d'aluminium (Al) solide ?
1. Il faut déterminer, à l'aide du tableau du potentiel standard de réduction, la valeur des Eº pour chacune des demi-réactions.
|Cu^{2+}_{(aq)} + 2 e^- \rightarrow Cu_{(s)}| E° = + 0,34 V
|Al_{(s)} \rightarrow Al^{3+}_{(aq)} + 3 e^-| E° = + 1,66 V
On change le signe – devant 1,66 V en + 1,66 V, car on doit inverser l'équation partielle impliquant le |Al_{(s)}| afin d'obéir à la réaction désirée. Ici |Cu^{2+}_{(aq)}| et |Al_{(s)}| sont les réactifs.
2. On doit s'assurer que le nombre total d'électrons échangés est respecté. On obtient:
|3 Cu^{2+}_{(aq)} + 6 e^-| → |3 Cu_{(s)}| E° = + 0,34 V
|2 Al_{(s)}| → |2 Al^{3+}_{(aq)} + 6 e^-| E° = + 1,66 V
Attention! Les potentiels de réduction ne sont pas affectés lorsqu’on multiplie les équations par une constante.
3. Il faut maintenant déterminer l'équation globale.
|2 Al_{(s)} + 3 Cu^{2+}_{(aq)}| → |2 Al^{3+}_{(aq)} + 3 Cu_{(s)}|
E° total = + 2,00 V
4. Il y aura une réaction spontanée, car l'Eº totale est positif, il sera donc impossible de conserver une solution de |Cu^{2+}_{(aq)}| dans un récipient de Al.
Une des applications les plus importantes d'une réaction spontanée est la pile électrochimique. Selon la loi de la conservation de l'énergie, une pile électrochimique transforme spontanément de l'énergie chimique en énergie électrique
La pile électrochimique est composée de deux électrodes, nommées demi-piles, chacune constituée d'une pièce de métal plongée dans une solution ionique. Les deux électrodes sont reliées par un fil alors que les deux solutions sont reliées par un pont salin, c'est-à-dire un tube rempli d'une solution d'ions spectateurs ne participant pas à la réaction. Ce sont les échanges de charges entre les deux demi-piles (courant électrique) et les ions dans la solution qui permettent à la pile électrochimique d'effectuer la conversion entre les deux formes d'énergie.
La pile zinc-cuivre est un exemple classique de pile électrochimique. Voici le schéma de cette pile électrochimique :
Nous utiliserons une pile impliquant la réaction spontanée se produisant entre des électrodes de Zn en solution (|ZnSO_{4}|) et de Cu en solution (|CuSO_{4}|).
Une électrode est habituellement une tige, un fil ou une plaque conductrice d’électricité qui permet l’échange des charges électriques à la fois dans le circuit extérieur et dans la solution. L’électrode à l’origine des électrons se nomme anode et l’électrode qui reçoit les électrons se nomme la cathode.
Afin de déterminer l’électrode qui recevra les électrons, on doit déterminer parmi les deux demi-réactions impliquant le Zn et le Cu en solution le meilleur receveur d’électrons ou le meilleur oxydant. On consulte alors à cet effet les valeurs des Eº à l’aide du tableau du potentiel standard de réduction.
Il est à noter que l’on ne s’occupera pas de la présence des ions |SO^{2-}_{4(aq)}|, car ils sont considérés comme des ions spectateurs. Cela signifie que ces ions n’ont pas de rôle à jouer dans la réaction d’oxydo-réduction. Dans cette réaction, les ions de Cu possèdent une charge de 2+ car la charge des ions |SO_{4}| est toujours de 2-.
|Cu^{2+}_{(aq)} + 2 e^-| → |Cu_{(s)}| E° = + 0,34 V
|Zn^{2+}_{(aq)} + 2 e^-| → |Zn_{(s)}| E° = - 0,76 V
On remarque que les ions |Cu^{2+}_{(aq)}| possèdent un Eº plus élevé que celui des ions |Zn^{2+}_{(aq)}|. Les électrons seront donc captés par l’électrode de Cu et ils seront fournis par l’électrode de Zn. L’électrode de Zn est donc l’anode alors que l’électrode de Cu est la cathode.
Dans une pile électrochimique, les ions se déplacent d’une électrode à l’autre. On doit les ralentir afin que la durée de la réaction chimique (et par conséquent le temps d’utilisation de la pile) soit raisonnable. On utilise donc un pont salin qui contient une solution électrolytique comme du |KCl| ou du |KNO_{3}|. Le choix de la nature du pont salin favorise l’utilisation d’ions spectateurs afin de ne pas créer des réactions secondaires indésirables.
Les ions présents dans le pont salin servent en quelque sorte à remorquer les autres ions. Les ions négatifs, ou anions (dans ce cas les |SO_{4}^{2-}|), se dirigeront vers l’anode alors que les ions positifs, ou cations, se dirigeront vers la cathode (dans ce cas-ci les ions |Cu^{2+}| et |Zn^{2+}|). On peut remplacer le pont salin par une paroi poreuse composée d’un matériau qui permet le déplacement des ions en solution tout en empêchant que la réaction ne se produise trop rapidement.
L’utilisation d’un voltmètre permet de mesurer la différence de potentiel (ddp) ou tension exprimée en volt entre les deux demi-piles. Le sens du déplacement de l’aiguille du voltmètre correspond au sens du déplacement des électrons dans la pile. L’utilisation d’un ampèremètre permet de mesurer le courant dans la pile.
Il est possible de prévoir la tension (ou la ddp) d’une pile électrochimique.Dans l’exemple précédent soit celui de la pile, on peut se baser sur le tableau du potentiel standard de réduction en utilisant les demi-réactions de réduction:
|Cu^{2+}_{(aq)} + 2 e^- \rightarrow Cu_{(s)}| E° = + 0,34 V
|Zn^{2+}_{(aq)} + 2 e^- \rightarrow Zn_{(s)}| E° = - 0,76 V
On remarque que le |Cu^{2+}_{(aq)}| est un meilleur accepteur d’électrons que le |Zn^{2+}_{(aq)}|, on doit donc inverser l’équation du Eº le plus faible soit celle impliquant le |Zn^{2+}_{(aq)}|. On obtient donc la possibilité d’additionner ces deux demi-réactions:
|Cu^{2+}_{(aq)} + 2 e^- \rightarrow Cu_{(s)}| E° = + 0,34 V
|Zn_{(s)} \rightarrow Zn^{2+}_{(aq)} + 2 e^-| E° = + 0,76 V
Équation globale d'oxydoréduction:
|Zn_{(s)} + Cu^{2+}_{(aq)} \rightarrow Zn^{2+}_{(aq)} + Cu_{(s)}|
E°total = + 1,10 V