<!DOCTYPE html PUBLIC "-//W3C//DTD HTML 4.0 Transitional//EN" "http://www.w3.org/TR/REC-html40/loose.dtd">
<html><body><p>Pour prédire l'effet d'une variation de concentration, des réactifs autant que des produits, sur l'état d'équilibre, il faut simplement suivre le principe de Le Chatelier. La variation de la concentration d'une seule substance peut en effet perturber un état d'équilibre. En fonction du <a href="/fr/eleves/bv/chimie/le-principe-de-le-chatelier-c1042">principe de Le Chatelier</a>, on peut résumer les conséquences d'une variation de concentration de la façon suivante:</p>
</body></html>
Lorsque l'on modifie la concentration d'un réactif ou d'un produit, la réaction à l'équilibre tend à s'opposer à cette modification.
- Une augmentation de la concentration d'un réactif tend à favoriser la réaction directe.
- Une augmentation de la concentration d'un produit tend à favoriser la réaction inverse.
- Une diminution de la concentration d'un réactif tend à favoriser la réaction inverse.
- Une diminution de la concentration d'un produit tend à favoriser la réaction directe.
Pour comprendre l’effet d’une variation de la concentration sur l’état d’équilibre, prenons l’exemple suivant:
|N_{2(g)} + 3\; H_{2(g)} \rightleftharpoons 2\; NH_{3(g)}|
Selon le principe de Le Chatelier, un système à l'équilibre réagit de façon à s'opposer en partie aux changements qu'on lui impose. Ainsi, à la suite d'une augmentation de la concentration d'un réactif, le système réagira de manière opposée et favorisera le sens de la réaction utilisant ce surplus de réactifs, soit la réaction directe.
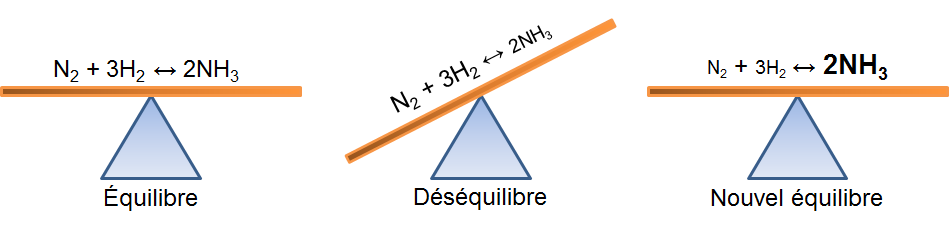
Dans l'exemple qui nous intéresse, une augmentation de diazote crée un déséquilibre qui favorise la réaction directe. Pour retrouver un nouvel état d'équilibre, le système s'oppose en utilisant ce surplus de réactifs. Ainsi, il favorise la réaction directe et cela cause une diminution des réactifs et une augmentation des produits. On peut illustrer l'effet d'une telle variation des deux façons suivantes:
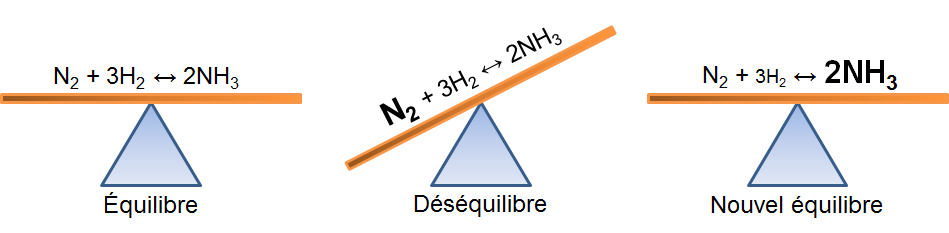
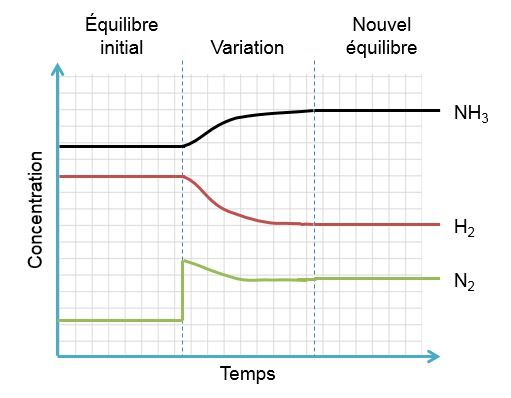
Selon le principe de Le Chatelier, un système à l'équilibre réagit de façon à s'opposer en partie aux changements qu'on lui impose. Ainsi, à la suite d'une augmentation de la concentration d'un produit, le système réagira de manière opposée et favorisera le sens de la réaction utilisant ce surplus de produits, soit la réaction inverse.
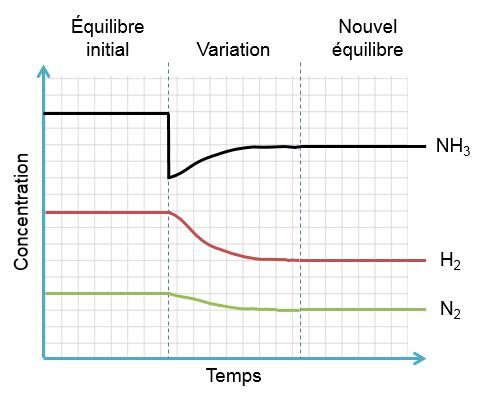
Dans l'exemple qui nous intéresse, une augmentation d'ammoniac crée un déséquilibre qui favorise la réaction inverse. Pour retrouver un nouvel état d'équilibre, le système s'oppose en utilisant ce surplus de produits. Ainsi, il favorise la réaction inverse et cela cause une augmentation des réactifs et une diminution des produits. On peut illustrer l'effet d'une telle variation des deux façons suivantes:
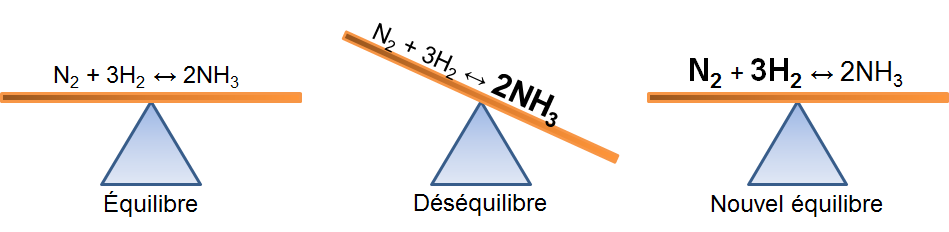
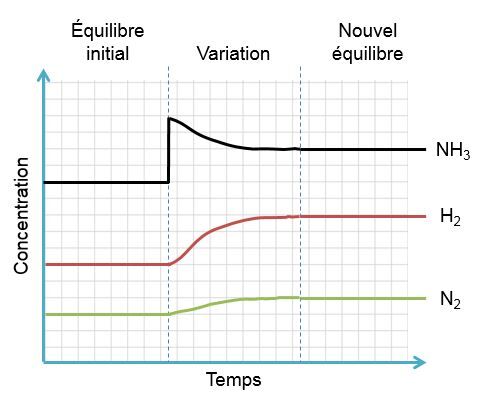
Selon le principe de Le Chatelier, un système à l'équilibre réagit de façon à s'opposer en partie aux changements qu'on lui impose. Ainsi, à la suite d'une diminution de la concentration d'un réactif, le système réagira de manière opposée et favorisera le sens de la réaction palliant ce manque de réactifs, soit la réaction inverse.
Dans l'exemple qui nous intéresse, une diminution de diazote crée un déséquilibre qui favorise la réaction inverse. Pour retrouver un nouvel état d'équilibre, le système s'oppose en palliant à ce manque de réactifs. Ainsi, il favorise la réaction inverse et cela cause une augmentation des réactifs et une diminution des produits. On peut illustrer l'effet d'une telle variation des deux façons suivantes:

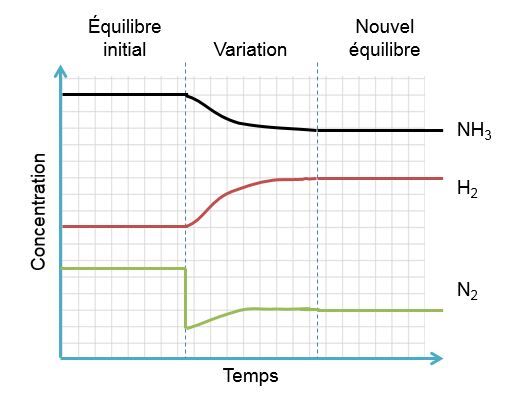
Selon le principe de Le Chatelier, un système à l'équilibre réagit de façon à s'opposer en partie aux changements qu'on lui impose. Ainsi, à la suite d'une diminution de la concentration d'un produit, le système réagira de manière opposée et favorisera le sens de la réaction palliant ce manque de produits, soit la réaction directe.
Dans l'exemple qui nous intéresse, une diminution d'ammoniac crée un déséquilibre qui favorise la réaction directe. Pour retrouver un nouvel état d'équilibre, le système s'oppose en palliant à ce manque de produits. Ainsi, il favorise la réaction directe et cela cause une diminution des réactifs et une augmentation des produits. On peut illustrer l'effet d'une telle variation des deux façons suivantes:
| Changement imposé | Schématisation | Réaction favorisée |
| Augmentation des réactifs |  |
Réaction directe |\large \rightarrow| |
| Diminution des réactifs | 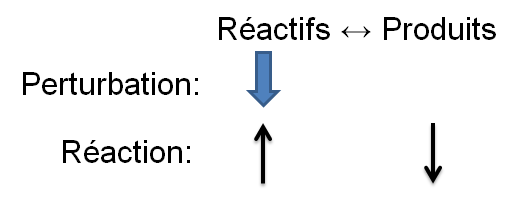 |
Réaction inverse |\large \leftarrow| |
| Augmentation des produits | 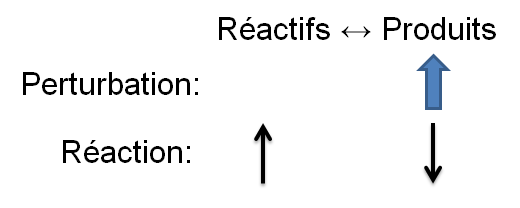 |
Réaction inverse |\large \leftarrow| |
| Diminution des produits | 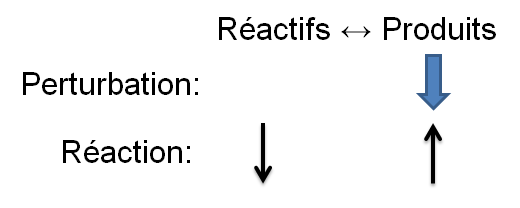 |
Réaction directe |\large \rightarrow| |