Pour prédire l'effet d'une variation de température sur l'état d'équilibre, il faut tenir compte de l'énergie impliquée au cours de la réaction. L'effet sera différent en fonction de la nature exothermique ou endothermique de cette réaction. Selon le principe de Le Chatelier, on peut résumer les conséquences d'une variation de température de la façon suivante:
Lorsque l'on augmente la température, la réaction à l'équilibre tend à s'opposer à cette augmentation d'énergie.
- Une augmentation de température déplace l'équilibre en favorisant la réaction endothermique.
- Une diminution de température déplace l'équilibre en favorisant la réaction exothermique.
Pour comprendre l’effet d’une variation de la température sur l’état d’équilibre, prenons l’exemple suivant:
|N_{2(g)} + 3\; H_{2(g)} \rightleftharpoons 2\; NH_{3(g)} + \acute{e}nergie|
Selon le principe de Le Chatelier, un système à l'équilibre réagit de façon à s'opposer en partie aux changements qu'on lui impose. Ainsi, suite à un apport d'énergie causé par une augmentation de température, le système réagira de manière opposée et favorisera le sens de la réaction utilisant de l'énergie, soit la réaction endothermique.
Dans l'exemple qui nous intéresse, une augmentation de température crée un déséquilibre qui favorise la réaction directe. Pour retrouver un nouvel état d'équilibre, le système s'oppose en utilisant ce surplus d'énergie. Ainsi, la réaction endothermique est avantagée ce qui cause une augmentation des réactifs dans notre exemple; la réaction inverse est alors favorisée puisque l'apport d'énergie force le produit à réagir.
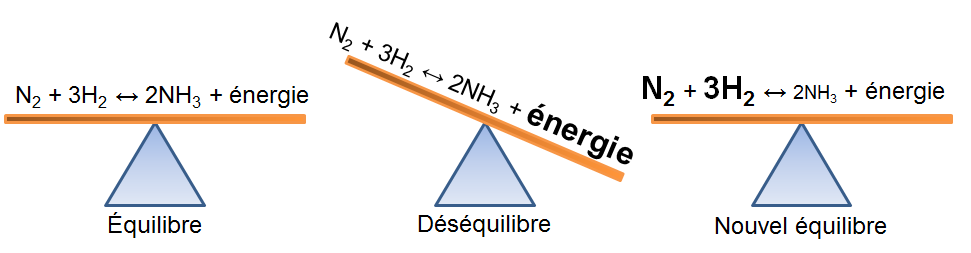
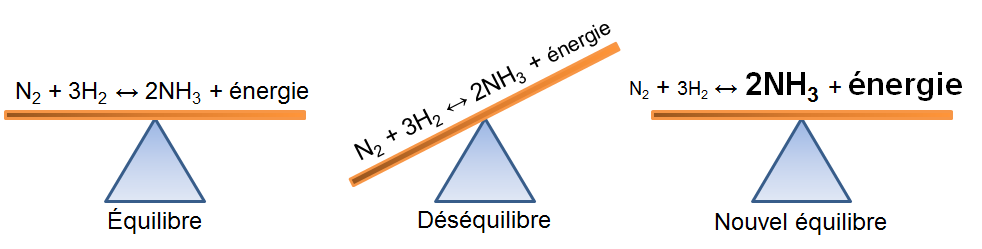
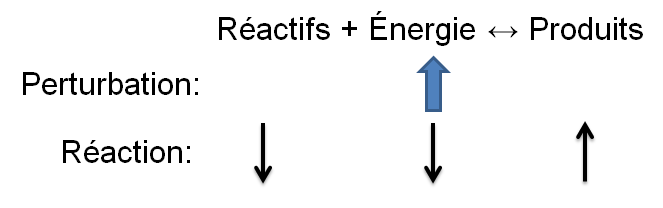
Selon le principe de Le Chatelier, un système à l'équilibre réagit de façon à s'opposer en partie aux changements qu'on lui impose. Ainsi, suite à un retrait d'énergie causé par une diminution de température, le système réagira de manière opposée et favorisera le sens de la réaction produisant de l'énergie, soit la réaction exothermique.
Dans l'exemple qui nous intéresse, une diminution de température crée un déséquilibre qui favorise la réaction inverse. Pour retrouver un nouvel état d'équilibre, le système s'oppose en palliant à ce manque d'énergie. Ainsi, la réaction exothermique est favorisée ce qui cause une diminution des réactifs dans notre exemple; la réaction directe est alors favorisée puisque le manque d'énergie force les réactifs à réagir.
| Changement imposé | Schématisation | Réaction favorisée |
| Augmentation de la température | 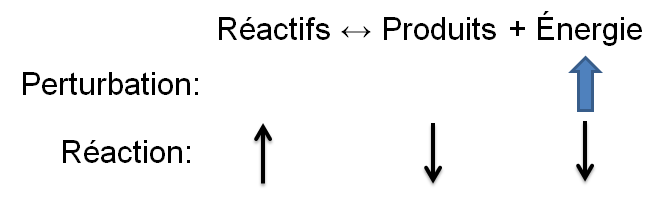
|
Réaction inverse
|\large \leftarrow|
|
 |
Réaction directe |\large \rightarrow| |
|
| Diminution de la température | 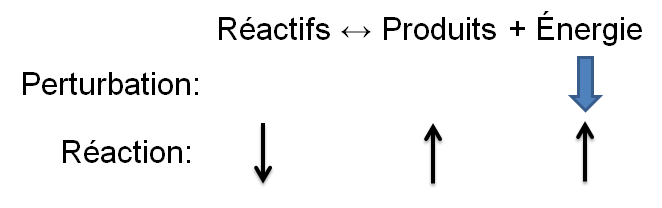 |
Réaction directe |\large \rightarrow| |
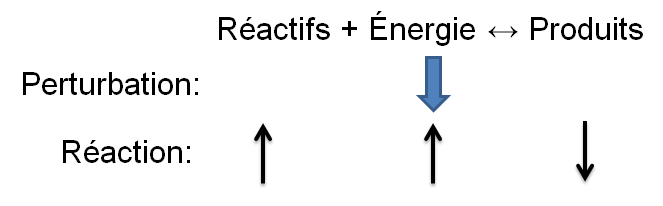 |
Réaction inverse |\large \leftarrow| |