<!DOCTYPE html PUBLIC "-//W3C//DTD HTML 4.0 Transitional//EN" "http://www.w3.org/TR/REC-html40/loose.dtd">
<html><body><p>Afin de bien comprendre les <a href="/fr/eleves/bv/chimie/la-constante-d-acidite-ka-c1045">constantes d'acidité et de basicité</a>, il est important de modifier un peu notre définition des termes «acide» et «base». Généralement, on les décrit à l'aide de leurs propriétés macroscopiques et de leur structure moléculaire. On les définit alors en fonction des ions qu'ils produisent. Toutefois, cette définition présente certaines limites puisqu'elle ne permet pas d'expliquer de façon satisfaisante leur comportement. Afin de dépasser ces limites et de mieux définir ces substances, diverses théories ont été élaborées:</p>
</body></html>
Selon la théorie d'Arrhenius:
- Un acide est une substance qui, lorsque mise en solution aqueuse, libère des ions hydrogène |(H^{+})|.
- Une base est une substance qui, lorsque mise en solution aqueuse, libère des ions hydroxyde |(OH^{-})|.
En 1887, le chimiste suédois Svante Arrhenius élabore la première théorie sur les acides et les bases. Cette théorie forme la base de notre définition actuelle des acides et des bases. Élaborée à partir de l'observation des ions que ces substances ont tendance à former, un acide est défini comme une substance produisant des ions |(H^{+})| en solution alors qu'une base produit des ions |(OH^{-})|.
| Acides qui se dissocient dans l'eau et les ions qui en résultent | Bases qui se dissocient dans l'eau et les ions qui en résultent |
| |HBr_{(aq)} \rightarrow H^{+}_{(aq)} + Br^{-}_{(aq)}| | |LiOH_{(aq)} \rightarrow Li^{+}_{(aq)} + OH^{-}_{(aq)}| |
| |H_{2}SO_{4(aq)} \rightarrow H^{+}_{(aq)} + HSO^{-}_{4(aq)}| | |KOH_{(aq)} \rightarrow K^{+}_{(aq)} + OH^{-}_{(aq)}| |
| |HClO_{4(aq)} \rightarrow H^{+}_{(aq)} + ClO^{-}_{4(aq)}| | |Ba(OH)_{2(aq)} \rightarrow Ba^{2+}_{(aq)} + 2\; OH^{-}_{(aq)}| |
La théorie d'Arrhenius procure une description simple des acides et des bases et elle est utile pour décrire leur dissociation électrolytique. Cependant, afin de respecter cette théorie, la structure moléculaire d'un acide doit contenir au minimum un atome d'hydrogène comme source d'ions hydrogène alors que celle d'une base doit contenir au moins un atome d'oxygène et un d'hydrogène afin de pouvoir générer un ion hydroxyde. Toutefois, on remarque parfois certains comportements basiques (comme le fait de bleuir le papier tournesol rouge) chez des molécules qui ne respectent pas cette structure. Ainsi, la théorie d'Arrhenius, bien que simple et pratique, présente certaines limites:
- Elle ne permet pas d'expliquer la formation d'ions hydronium |(H_{3}O^{+})| formé par l'attraction de l'eau et d'un ion hydrogène lors de la dissociation électrolytique d'un acide. En effet, l'ion |H^{+}| aqueux n'existe pratiquement pas en milieu aqueux puisqu'il a tendance à réagir avec la molécule d'eau de par sa polarité.
- Elle ne permet pas d'expliquer le comportement basique de certaines substances ne renfermant pas d'atomes nécessaires à la production d'ions hydroxyde, comme dans le cas du |NH_{3}| ou du |CaCO_{3}|.
- Elle ne permet pas d'expliquer des réactions entre des acides et des bases qui se produisent ailleurs qu'en milieu aqueux.
Selon la théorie de Brønsted-Lowry:
Un acide est une substance capable de donner un ou plusieurs protons sous forme d'ion hydrogène |H^{+}| à une autre substance : c'est un donneur de proton.
Une base est une substance capable de recevoir un ou plusieurs protons sous forme d'ion hydrogène |H^{+}| provenant d'une autre substance : c'est un accepteur de proton.
Un ion hydrogène est un atome d'hydrogène qui a perdu son électron unique. Il ne lui reste plus qu'un proton dans le noyau. C'est pourquoi, dans l'encadré ci-dessus, on parle de donneur et accepteur de proton.
En 1923, les chimistes Johannes BrØnsted et Thomas Lowry élaborent une théorie sur les acides et les bases permettant de régler les problèmes posés par la théorie d'Arrhenius. Cette théorie met davantage l'accent sur les rôles qu'ont les acides et les bases lors d'une réaction chimique plutôt que sur leurs propriétés dans les solutions aqueuses.
Tout comme dans la théorie d'Arrhenius, la formule moléculaire d'un acide selon BrØnsted-Lowry doit contenir un atome d'hydrogène. Par contre, tout ion négatif quel qu'il soit peut jouer le rôle de base afin d'accepter le proton donné par l'acide. Autrement dit, étant donné que cette théorie est basée sur le transfert d'un proton plutôt que sur la structure des molécules impliquées, chaque acide libérant un proton doit être accompagné d'une base capable de recevoir ce proton.
On nomme «acide conjugué d'une base» la particule formée par la base qui a capté un proton alors que la particule restant lorsque l'acide a perdu un proton se nomme «base conjuguée d'un acide».
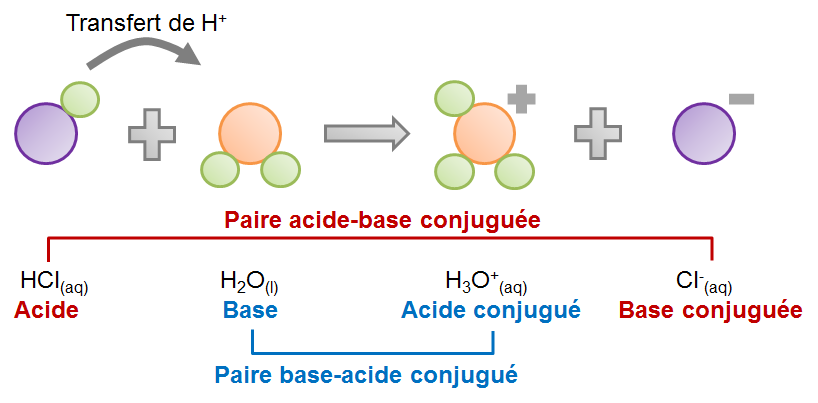
Réaction entre l'acide chlorhydrique et l'eau selon la théorie de BrØnsted-Lowry :
Réaction entre l'ammoniac et l'eau selon la théorie de BrØnsted-Lowry :
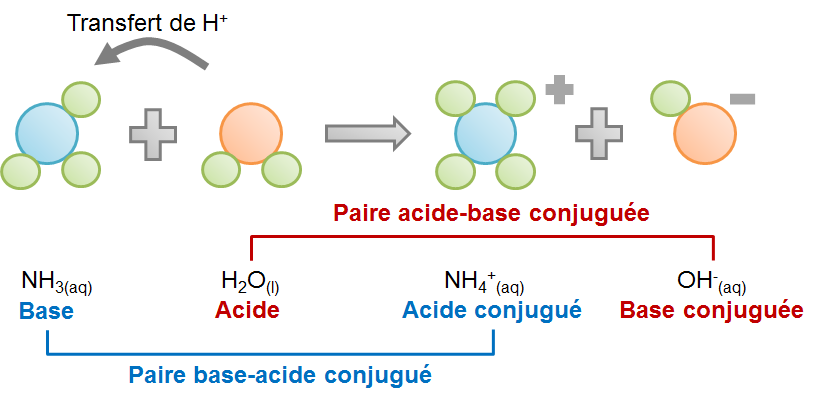
D'après cette théorie, n'importe quelle substance peut agir comme une base en autant qu'au même moment une autre substance se comporte comme un acide. Aussi, on ne peut classer une substance comme acide ou base uniquement selon une réaction donnée. En effet, selon la réaction considérée, il arrive qu'une même substance puisse tantôt jouer le rôle d'un acide, tantôt d'une base. C'est d'ailleurs le cas de la molécule d'eau dans les deux exemples ci-haut. En présence de l'acide chlorhydrique, l'eau est une base puisqu'elle recevra le proton perdu par l'acide. Toutefois, en présence de l'ammoniac, l'eau joue le rôle d'un acide étant donné la perte d'un proton au profit de l'ammoniac. Une telle substance qui, comme l'eau, peut jouer les deux rôles selon la réaction considérée est une substance amphotère.