La réactivité chimique d'un gaz est sa tendance à subir une transformation chimique sous l'effet de divers facteurs comme la chaleur, la lumière ou le contact avec une autre substance.
<!DOCTYPE html PUBLIC "-//W3C//DTD HTML 4.0 Transitional//EN" "http://www.w3.org/TR/REC-html40/loose.dtd">
<html><body><p>Les <a href="/fr/eleves/bv/chimie/les-proprietes-physiques-des-gaz-c1003">propriétés physiques des gaz</a> peuvent être généralisées à pratiquement l'ensemble des substances gazeuses. Elles ne permettent donc pas d'identifier les gaz puisqu'elles sont non caractéristiques. Au contraire, les <a href="/fr/eleves/bv/chimie/les-proprietes-chimiques-des-gaz-c1001">propriétés chimiques</a> sont caractéristiques à un gaz ou à un groupe de gaz particulier. Ainsi, afin de distinguer un gaz d'un autre, on peut utiliser la réactivité chimique des gaz, c'est-à-dire la façon de réagir chimiquement sous certaines conditions.</p>
<p>Connaître la réactivité chimique des gaz a plusieurs applications possibles. Cela permet entre autres d'<strong>identifier</strong> certains gaz. Par exemple, si un gaz brouille de l'eau de chaux, il s'agit de dioxyde de carbone. Aussi, on peut déterminer l'<strong>utilisation</strong> que l'on pourra en faire et quelles applications technologiques pourront les employer. Par exemple, on utilise le gaz naturel dans certains fours puisqu'il s'agit d'un excellent combustible. La réactivité chimique du gaz déterminera aussi les <strong>règles de sécurité</strong> à respecter lors de la manipulation d'un gaz. Finalement, tous les gaz peuvent avoir un effet asphyxiant ou suffocant lorsqu'ils prennent la place du dioxygène. Des détecteurs permettent donc de signaler une concentration de gaz trop près du <strong>seuil de toxicité.</strong></p>
</body></html>
La réactivité chimique d'un gaz dépend principalement de la configuration électronique des atomes. Plus particulièrement, c'est l'interaction entre les noyaux et les électrons de valence qui influence la réactivité d'un gaz. Cette configuration électronique détermine si un atome a tendance à gagner ou perdre des électrons.
Les gaz nobles, comme le néon (à gauche ci-dessous), ont une faible réactivité chimique, car leur couche de périphérie est remplie au maximum. À l'opposé, les halogènes, comme le chlore (à droite ci-dessous), ont une forte réactivité chimique, car il leur manque un électron pour combler la dernière couche.
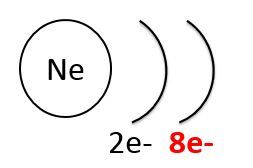
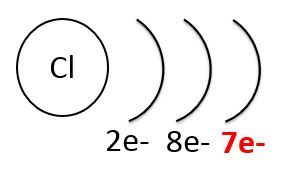
La réactivité chimique dépend aussi de la force des liaisons entre les atomes qui forment la molécule. Pour qu'il y ait formation de nouvelles molécules, il faut que les liaisons à l'intérieur des molécules des réactifs se brisent. Plus l'énergie requise est grande et moins la molécule est réactive.
Le fluor (|F_{2}|) est plus réactif que l'oxygène (|O_{2}|), car la simple liaison entre les deux atomes de fluor est plus faible que la double liaison du dioxygène.

Finalement, la réactivité chimique d'une substance est fonction du bilan énergétique de la réaction à laquelle la substance prend part. Ce bilan énergétique correspond à la différence entre l'énergie requise pour briser des liaisons chimiques et l'énergie dégagée lors de leurs formations.
De par leur configuration électronique, les gaz nobles sont chimiquement très stables. En effet, comme leur couche électronique périphérique est saturé, ils ne cherchent pas à gagner ou perdre des électrons. Ainsi, ils ne forment pas de liens chimiques avec d'autres atomes et on les retrouve sous forme d'éléments simples dans la nature.
On les utilise généralement dans des applications où l'on doit créer un milieu inerte, c'est-à-dire un milieu qui ne contient aucune substance susceptible de réagir chimiquement. C'est le cas dans certaines applications comme les tubes fluorescents, les ampoules incandescentes et la soudure à l'arc.
Cinq tubes à gaz nobles dans lesquels passe un courant électrique.
Un combustible est une substance inflammable qui peut brûler en présence d'un comburant.
Le combustible peut être solide, liquide ou gazeux. Parmi les gaz combustibles, on trouve les hydrocarbures et le dihydrogène.
Le butane, un type d'hydrocarbure, est utilisé comme combustible dans des fours fonctionnant au gaz naturel.
Un comburant est une substance qui cause la combustion.
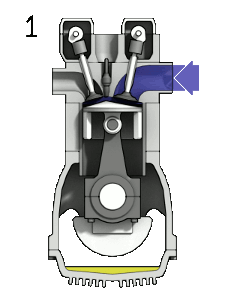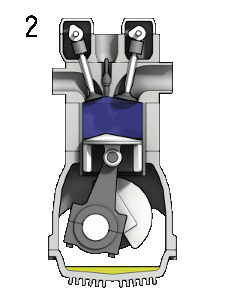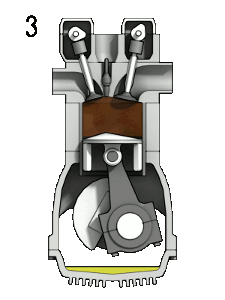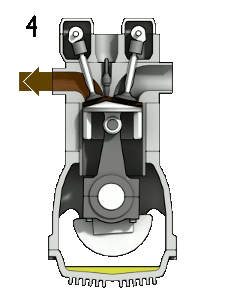
La majorité des comburants sont gazeux aux conditions ambiantes. Le comburant le plus répandu sur Terre est le dioxygène. Il participe à la plupart des réactions de combustion, qu'elles soient rapides comme l'explosion des vapeurs d'essence dans un moteur, ou lentes comme la respiration cellulaire. L'ozone est aussi un comburant, mais il est très toxique. Le difluor et le dichlore sont des comburants de la famille des halogènes. Leur forte réactivité les rend difficiles à conserver.
Dans un moteur à explosion, l'oxygène de l'air permet la combustion de la vapeur d'essence lorsque la bougie émet une étincelle.