La combustion est une réaction d’oxydation qui libère de l’énergie.
La combustion du glucose lors de la respiration cellulaire se déroule selon l’équation chimique suivante.
||\text{C}_6\text{H}_{12}\text{O}_{6\ \text{(aq)}}+6\ \text{O}_{2\ \text{(g)}}\rightarrow 6\ \text{CO}_{2\ \text{(g)}}+6\ \text{H}_2\text{O}_{\text{(l)}}+\text{Énergie}||
La combustion du méthane |(\text{CH}_4),| le principal composant du gaz naturel, se déroule selon l’équation chimique suivante.
||\text{CH}_{4\ \text{(g)}}+2\ \text{O}_{2\ \text{(g)}}\rightarrow\text{CO}_{2\ \text{(g)}}+2\ \text{H}_2\text{O}_{\text{(l)}}+\text{Énergie}||
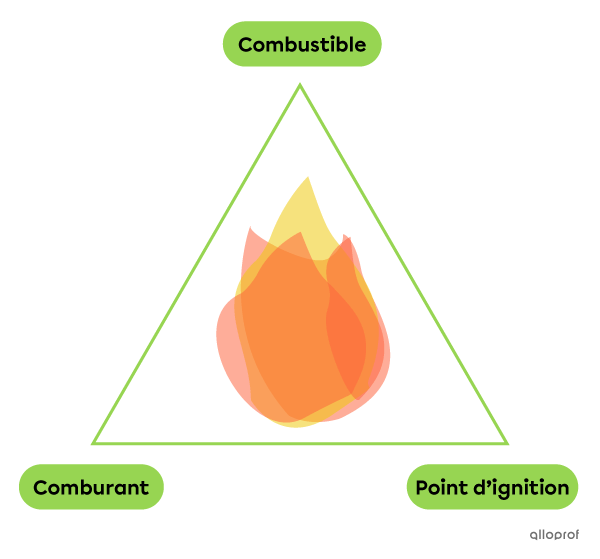
Le triangle de feu aide à se rappeler que 3 éléments sont nécessaires pour qu’une combustion ait lieu. Ces éléments sont :
- le combustible;
- le comburant;
- l’atteinte du point d’ignition.
Si l’un des éléments du triangle de feu n’est plus présent, la combustion s’arrête.
-
Le combustible est la substance qui brule. Le bois, le papier et les combustibles fossiles (pétrole, charbon, gaz naturel, etc.) sont des exemples de combustibles.
-
Le comburant est la substance qui entretient la combustion. Le comburant le plus courant est le dioxygène |(\text{O}_2),| car il est présent dans l’air.
-
Le point d’ignition est la température minimale que le combustible et le comburant doivent atteindre pour amorcer la combustion. Cette température est propre à chaque substance.
Si on tente d’allumer un feu de camp avec du bois humide, on risque d’avoir peu de succès. En effet, une partie de la chaleur qu’on fournit au bois mouillé est absorbée par l’eau pour favoriser sa vaporisation. Il faut donc fournir beaucoup plus de chaleur pour atteindre le point d’ignition du bois, ce qui rend l’allumage du feu plus difficile.
Tout dépendant de la façon dont la combustion est amorcée et de la vitesse à laquelle l’énergie est libérée, on peut classer les réactions de combustion selon 3 types.
La combustion vive libère de l’énergie rapidement sous forme de lumière et de chaleur. La combustion vive est généralement déclenchée à l’aide d’une flamme ou d’une étincelle.
Voici quelques exemples de combustion vive.

serhii.suravikin, Shutterstock.com
La combustion spontanée libère de l’énergie rapidement, tout comme la combustion vive, sauf qu’elle est amorcée sans l’aide d’une flamme ou d’une étincelle.
La combustion spontanée se produit lorsque la température du milieu ambiant permet d’atteindre le point d’ignition d’une substance.
Voici quelques exemples de situations pouvant causer une combustion spontanée.
-
En période de sécheresse, le risque de feu de forêt est plus élevé. En effet, le dioxygène |(\text{O}_2)| présent dans l’air et la chaleur ambiante peuvent enflammer spontanément les arbres.
-
La chaleur dégagée par la matière organique du foin peut déclencher un feu de grange.
-
Le potassium |(\text{K})| doit être conservé dans de l’huile, car sa réaction avec l’eau |(\text{H}_2\text{O})| produit du dihydrogène |(\text{H}_2)| et dégage beaucoup de chaleur. Cette chaleur est suffisante pour que le |\text{H}_2| s’enflamme spontanément au contact du |\text{O}_2| présent dans l’air.
Voici quelques exemples de combustion lente.
La respiration cellulaire qui a lieu dans les mitochondries des cellules.
Barou abdennaser, Shutterstock.com

La décomposition des restes de nourriture en compost.
pikselstock, Shutterstock.com

L’oxydation des métaux (corrosion).




