Les termes chaleur et température sont souvent confondus. Bien qu’ils soient tous deux reliés à l’énergie thermique, il s’agit pourtant de deux concepts distincts.
L’énergie thermique correspond à l’énergie associée à l’agitation des particules d’un échantillon.
L’énergie thermique d’une substance dépend :
-
de la quantité de particules (masse) dans la substance;
-
du degré d’agitation (température) de ces particules.
Le tableau qui suit montre la variation de l’énergie thermique en fonction de ces deux facteurs.
| Facteur | Variation du facteur | Résultat |
|---|---|---|
| Quantité de particules (masse) | La quantité de particules augmente. |\nearrow| | L’énergie thermique augmente. |\nearrow| |
| La quantité de particules diminue. |\searrow| | L’énergie thermique diminue. |\searrow| | |
| Température | La température augmente. |\nearrow| | L’énergie thermique augmente. |\nearrow| |
| La température diminue. |\searrow| | L’énergie thermique diminue. |\searrow| |
L’énergie thermique se mesure en joules |(\text{J}).| Contrairement à la température et à la masse, il n’existe pas d’instruments permettant la mesure directe de l’énergie thermique. Il faut donc recourir à des méthodes indirectes impliquant des calculs.
Pour valider ta compréhension à propos de l'énergie thermique de façon interactive, consulte la MiniRécup suivante :

La chaleur est un transfert d’énergie thermique entre deux systèmes de températures différentes.
Lorsque deux objets de températures différentes sont mis en contact, ils subissent un changement de température dû à la chaleur (transfert d'énergie thermique). En bref, l’objet initialement chaud devient plus froid et l’objet initialement froid devient plus chaud.
La chaleur va toujours de l’objet ayant la température la plus élevée à l’objet ayant la température la plus basse. À la suite de ce transfert, les deux objets ont la même température.
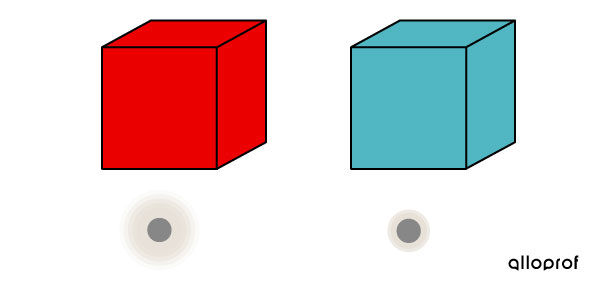
Le bloc 1, dont la température est plus élevée, contient des particules de matière très agitées.
Le bloc 2, dont la température est plus basse, contient des particules de matière moins agitées.
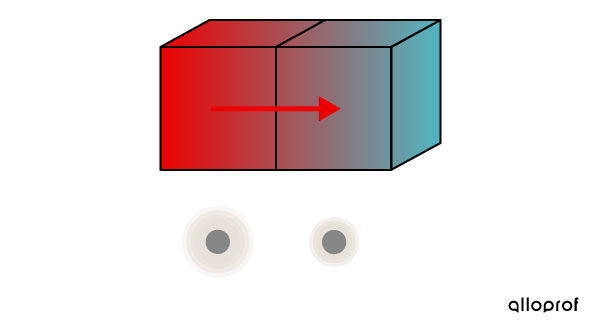
Lorsque les deux blocs sont mis en contact, les particules plus agitées du bloc 1 entrent en collision avec les particules moins agitées du bloc 2 et leur transfèrent de l'énergie thermique.
Les particules du bloc 1 deviennent moins agitées, alors que les particules du bloc 2 deviennent plus agitées.
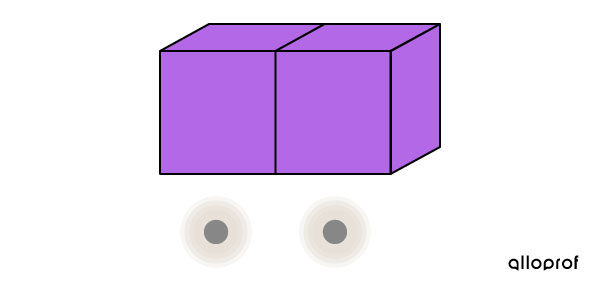
Au bout d’un certain temps, le transfert d’énergie thermique est complété. Les blocs ont la même température, donc leurs particules ont la même agitation.
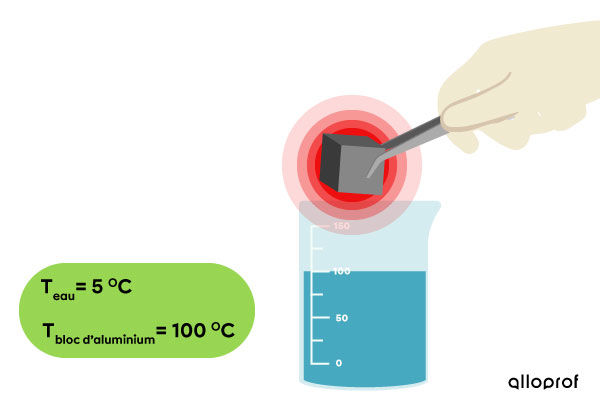
Pour démontrer le transfert d'énergie thermique (chaleur) entre deux substances, on plonge un bloc d’aluminium à |100\ °\text{C}| dans un bécher d’eau à |5\ °\text{C}| et on observe le changement de température.
-
Au départ, le bloc d’aluminium a une température de |100\ °\text{C}.|
L’eau a une température de |5\ °\text{C}.|
-
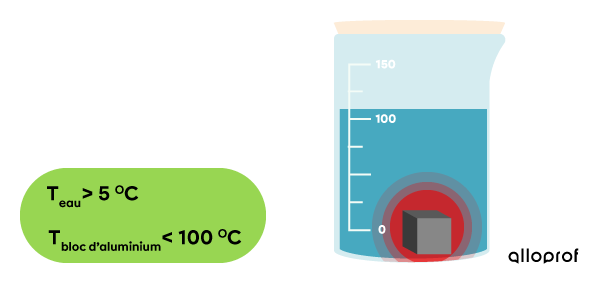
On plonge le bloc d’aluminium dans l’eau et on ajoute un couvercle pour limiter les pertes de chaleur vers l’air ambiant.
Le bloc d’aluminium et l’eau sont en contact : le transfert d'énergie thermique commence.
-
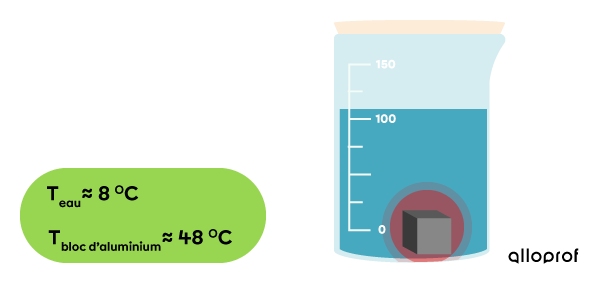
On observe que la température de l’eau augmente et que celle du bloc d’aluminium diminue.
-
Au bout d’un certain temps, la température du système est stable à |10\ °\text{C}.|
Le transfert de chaleur est complété.
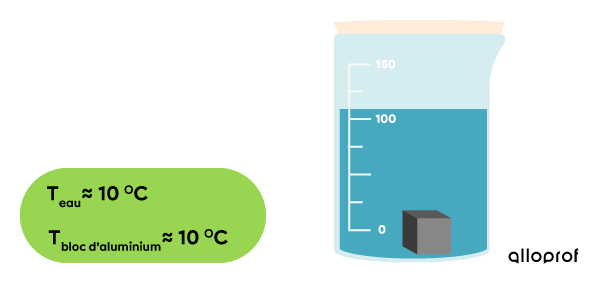
En résumé, l’eau a subi une augmentation de température en passant de |5\ °\text{C}| à |10\ °\text{C},| ce qui démontre un gain d’énergie thermique. Le cube d’aluminium a subi une diminution de température en passant de |100\ °\text{C}| à |10\ °\text{C},| ce qui démontre une perte d’énergie thermique.
Dans cet exemple, on considère qu’il n’y a pas de perte d’énergie vers l’air ambiant.
Quand on touche une table dont la surface est en bois et les pattes, en métal, la surface en bois semble plus chaude que le pied en métal. Pourtant, ces deux parties de la table sont dans la même pièce. Elles ont la même température. En comprenant bien la différence entre les concepts de température et de chaleur, on peut alors expliquer cette observation.
La table et le pied ont effectivement la même température. Or, ce qu’on sent quand on touche ces objets, ce n’est pas la température, mais la chaleur que les objets dégagent ou absorbent.

Le bois est un isolant thermique. C’est pourquoi l’énergie thermique de la main, qui est plus chaude que le dessus de la table, se propage très peu dans le bois. Cela amène l’impression que le bois est plus chaud que le métal. À l’inverse, lorsqu’on touche une patte en métal de la table, la main transfère une plus grande quantité d’énergie thermique. La patte en métal absorbe la chaleur, car le métal est un conducteur thermique. Cela procure une sensation de froid dans la main parce que le morceau de métal absorbe plus de chaleur.
La température est la mesure du degré d’agitation des atomes et des molécules d’une substance.
La température est une propriété non caractéristique de la matière. Elle permet de quantifier l’agitation des particules d’une substance. Plus les particules sont agitées, plus la température est élevée.
La mesure de la température s’effectue à l’aide d’un thermomètre et ses unités sont le degré Celsius |(°\text{C}),| le degré Fahrenheit |(°\text{F})| et le kelvin |(\text{K}).|
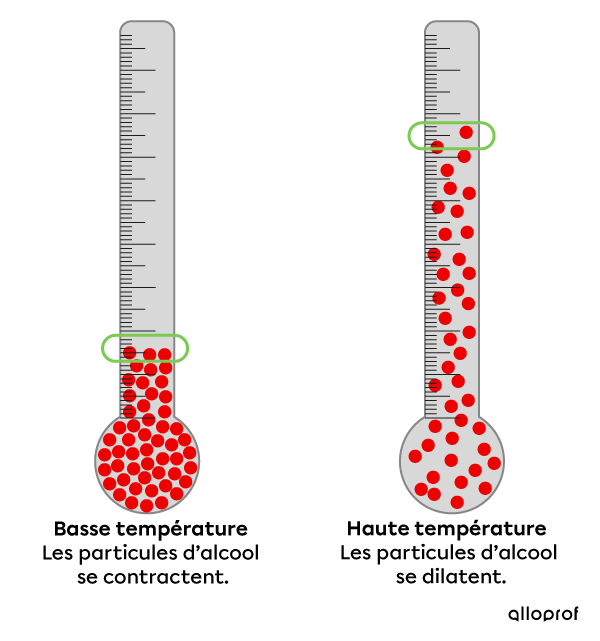
Le thermomètre à alcool utilise le principe de dilatation thermique pour mesurer la température d’une substance.
Lorsque la température est basse, le degré d’agitation est moindre et les particules d’alcool sont rapprochées les unes des autres.
Lors d’un apport d'énergie thermique, les particules d’alcool s’agitent davantage et prennent de l’expansion.
La graduation sur le tube de verre permet de faire une lecture chiffrée de la température.