C’est Antoine Laurent de Lavoisier qui a énoncé le principe de la conservation de la matière :
Lors d’une transformation, aucune matière n'est perdue et aucune matière n'est créée; la matière est transformée de son état initial vers un état final.
« Rien ne se perd, rien ne se crée, tout se transforme »
Ce principe nous permet d'affirmer que le nombre d'atomes de chaque sorte sera le même avant et après la transformation. Il en sera de même pour la masse: la masse des réactifs sera la même que celle des produits.
Pour un changement physique, la masse des réactifs et des produits restera la même, car ce sont les mêmes atomes et les mêmes molécules au début et à la fin de la réaction.
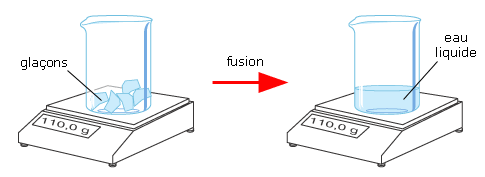
Pour facilement observer ce principe, il suffit de peser un bocal fermé rempli de glace et de le peser à nouveau lorsque la glace aura fondu. La masse totale ne changera pas.
<!DOCTYPE html PUBLIC "-//W3C//DTD HTML 4.0 Transitional//EN" "http://www.w3.org/TR/REC-html40/loose.dtd">
<html><body><p><span><a href="/fr/eleves/bv/sciences/les-changements-physiques-s1051">Les changements physiques</a></span></p>
</body></html>
<!DOCTYPE html PUBLIC "-//W3C//DTD HTML 4.0 Transitional//EN" "http://www.w3.org/TR/REC-html40/loose.dtd">
<html><body><p>Pour un changement chimique, le principe reste le même. La masse des réactifs et des produits restera la même, car ce sont les mêmes atomes au début et à la fin de la réaction. Il se produira un réarrangement des atomes pour former des nouvelles <a href="/fr/eleves/bv/sciences/l-atome-la-molecule-l-element-le-compose-et-s1103">molécules</a> à la fin de la réaction.</p>
</body></html>
Lorsqu'on fait chauffer de la poudre de cuivre (initialement de couleur orange), il en résulte une poudre plus granuleuse de couleur noire. L’oxygène |(O_{2})| contenu dans l’air ambiant s’est combiné avec les atomes de cuivre |(Cu)| pour former de l’oxyde de cuivre |(CuO)|. L'image suivante illustre la réaction.
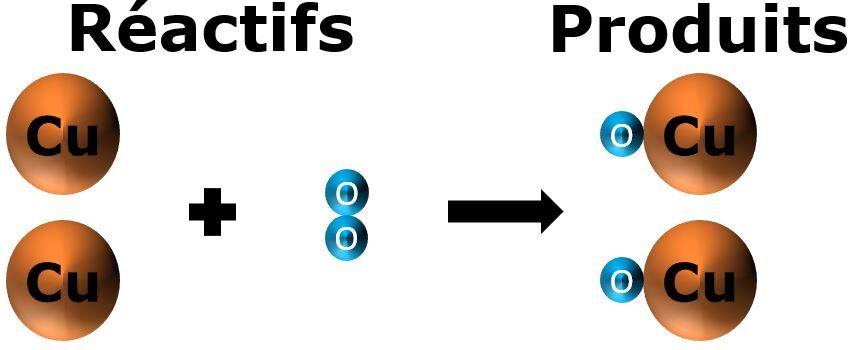
La matière a donc été conservée (il n’y a eu aucune perte).
Il y a deux atomes de cuivre du côté des réactifs et deux atomes de cuivre du côté des produits.
Il y a aussi deux atomes d’oxygène du côté des réactifs et deux atomes d’oxygène du côté des produits.
Il y a donc eu conservation de la masse. Lors du chauffage, les atomes ont formé de nouveaux liens. Ils ont créé une nouvelle substance qui n’a pas les mêmes propriétés que les substances initiales.
<!DOCTYPE html PUBLIC "-//W3C//DTD HTML 4.0 Transitional//EN" "http://www.w3.org/TR/REC-html40/loose.dtd">
<html><body><p><span><a href="/fr/eleves/bv/sciences/les-changements-chimiques-s1059">Les changements chimiques</a></span></p>
</body></html>
Le principe de Lavoisier indique que la masse des réactifs est égale à la masse de produits.
Sachant qu’on brûle 16 g de méthane |(CH_{4})| avec 64 g de dioxygène |(O_{2})| et que l’on produit alors 36 g de vapeur d’eau |(H_{2}O)|, quelle masse de dioxyde de carbone |(CO_{2})| sera alors formée ?
Il faut tout d'abord écrire la réaction chimique. Ensuite, on écrit sous chacune des molécules la masse utilisée ou produite dans la réaction chimique.
|CH_{4} + 2 O_{2} \rightarrow CO_{2} + 2 H_{2}O|
|16 g \space + 64 g \space \rightarrow \space x \space+ 36 g|
Les réactifs totalisent 80 g (16 g + 64 g). Par conséquence, la masse des produits devra être la même, soit 80 g, pour respecter le principe de la conservation de la masse.
Sachant qu'il y a 36 g d'eau dans les produits, la masse de |CO_{2}| est donc: |80 \space g - 36 \space g = 44 \space g|.
La masse de |CO_{2}| formée lors de la réaction est donc 44 g.