La solubilité est une propriété physique caractéristique. Il s’agit de la quantité maximale de soluté qui peut être dissoute dans un volume donné de solvant.
La solubilité se mesure en grammes par cent millilitres |(\text{g/100 mL})| ou en grammes par litre |(\text{g/L})|. Puisqu’elle influence la solubilité, on mentionne également la température à laquelle la solubilité a été mesurée.
Afin de calculer la solubilité en |\text{g/100 mL}|, on emploie la formule suivante.
||s= \dfrac{m\times100}{V}||
où
|s| représente la solubilité |(\text{g/100 mL})|
|m| représente la masse maximale du soluté |(\text{g})|
|V| représente le volume du solvant |(\text{mL})|
Un volume de |125\ \text{mL}| d’eau permet de solubiliser un maximum de |12{,}0\ \text{g}| de bicarbonate de sodium |(\text{NaHCO}_3)| à |20\ °\text{C}|. Quelle est la solubilité de ce soluté en |\text{g/100 mL}|?
On commence par lister les données présentes dans l’énoncé :
|\begin{align}V&=125\ \text{mL} &m=12{,}0\ \text{g}\\ s&=? \end{align}|
Sachant que |s= \dfrac{m\times100}{V}| lorsque |s| est en |\text{g/100 mL}| :
|\begin{align}s&=\dfrac{12{,}0\ \text{g} \times100}{125\ \text{mL}}\\s&\approx9{,}60\ \text{g}/100\ \text{mL} \end{align}|
Ainsi, la solubilité du bicarbonate de sodium |(\text{NaHCO}_3)| dans l’eau est de |9{,}60\ \text{g}/100\ \text{mL}| à |20\ °\text{C}.|
La solubilité du chlorure de sodium |(\text{NaCl})| dans l’eau est de |36{,}0\ \text{g}/100\ \text{mL}| à |25\ °\text{C}.| Quelle est la quantité minimale d’eau nécessaire pour dissoudre |150\ \text{g}| de chlorure de sodium?
On commence par lister les données présentes dans l’énoncé :
|\begin{align}s&=36{,}0\ \text{g}/100\ \text{mL} &m=150\ \text{g}\\ V&=? \end{align}|
Si |s= \dfrac{m\times100}{V}| lorsque |s| est en |\text{g/100 mL}|, alors |V= \dfrac{m\times100}{s}| :
|\begin{align}V&=\dfrac{150\ \text{g} \times 100}{36{,}0\ \text{g}/100\ \text{mL}}\\V&\approx417\ \text{mL} \end{align}|
Ainsi, il faudra au moins |417\ \text{mL}| d’eau pour dissoudre |150\ \text{g}| de chlorure de sodium |(\text{NaCl})| à |25\ °\text{C}.|
Il ne faut pas confondre la solubilité et la concentration. La solubilité est une propriété physique caractéristique, tandis que la concentration est une propriété physique non caractéristique d’une solution.
De plus, la solubilité fait allusion à la quantité maximale de soluté que l’on peut dissoudre dans un volume de solvant. Par contre, la concentration fait allusion à la quantité de soluté qui a été dissoute pour un volume total de solution.
Lors de la préparation d’une solution, il est important de connaitre la solubilité du soluté afin d’obtenir le mélange souhaité. En effet, si on cherche à dissoudre trop de soluté dans un solvant, seule une partie du soluté sera dissoute et le reste du soluté se déposera au fond du contenant. Ainsi, lorsque la limite de solubilité est atteinte, on dit que la solution est saturée. Lorsque la limite de solubilité est dépassée, le soluté en trop ne se dissout pas. On dit que la solution est sursaturée.
La solubilité du saccarose, un type de sucre, est d’environ |190\ \text{g/100 mL}| dans l’eau à |25\ °\text{C}|.
| Une solution non saturée de saccharose | Une solution sursaturée de saccharose |
|---|---|
 |
 |
| Ici, |100\ \text{g}| de saccarose sont dissouts dans |100\ \text{mL}| d’eau. La quantité de soluté ne dépasse pas sa solubilité. Le mélange est homogène. | Ici, |250\ \text{g}| de saccarose sont mélangés à |100\ \text{mL}| d’eau. La quantité de soluté dépasse sa solubilité. Il reste du soluté non dissout au fond du verre. Le mélange est hétérogène. |
De multiples facteurs peuvent avoir une influence sur la solubilité d’un soluté : la nature du soluté, la nature du solvant, la température de la solution, la pression, etc.
Tous les solutés n’ont pas la même solubilité. L’oxygène, qui est un gaz, est peu soluble dans l’eau. À l’inverse, le chlorure de sodium, un sel solide, est très soluble dans l’eau. Par contre, l’aluminium est un solide très peu soluble dans l’eau.
Par ailleurs, les solvants n’ont pas tous la même capacité à dissoudre un soluté. Le chlorure de sodium (sel de table) est très soluble dans l’eau, mais peu soluble dans l’éthanol.
Le tableau suivant met en évidence la différence de solubilité de divers solutés dans l’eau à |20\ °\text{C}.|
| Soluté | Solubilité dans l’eau (|\text{g/100 mL}| à |20\ °\text{C}|) |
|---|---|
| Oxygène gazeux |(\text{O}_2)| | |0{,}001| |
| Chlorure de sodium |(\text{NaCl})| | |35{,}7| |
| Hydroxyde de sodium |(\text{NaOH})| | |111{,}1| |
| Glucose |(\text{C}_6\text{H}_{12}\text{O}_6)| | |100{,}0| |
| Éthanol |(\text{C}_2\text{H}_6\text{O})| | Miscible en toute proportion |
La température a une grande influence sur la solubilité des solutés. Généralement, la solubilité des solutés liquides et solides augmente lorsque la température de la solution augmente. Une plus grande agitation des particules de solvant favorise le mélange des particules de soluté.
Dans le cas des solutés gazeux, une augmentation de la température diminue leur solubilité dans un solvant liquide. Dans ce cas, les molécules de gaz sont trop agitées pour se mélanger adéquatement à un liquide. Une augmentation de la température augmente l’agitation déjà excessive des particules de gaz, ce qui amène les particules gazeuses à quitter la solution.
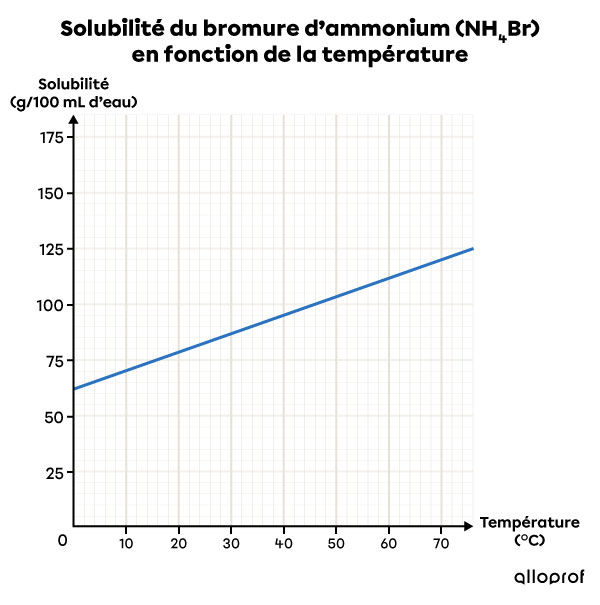
Ce graphique de solubilité montre que plus la température augmente, plus la solubilité du bromure d’ammonium |(\text{NH}_4\text{Br})| dans l’eau est grande. Ainsi, l’eau chaude est un meilleur solvant que l’eau froide pour ce soluté.
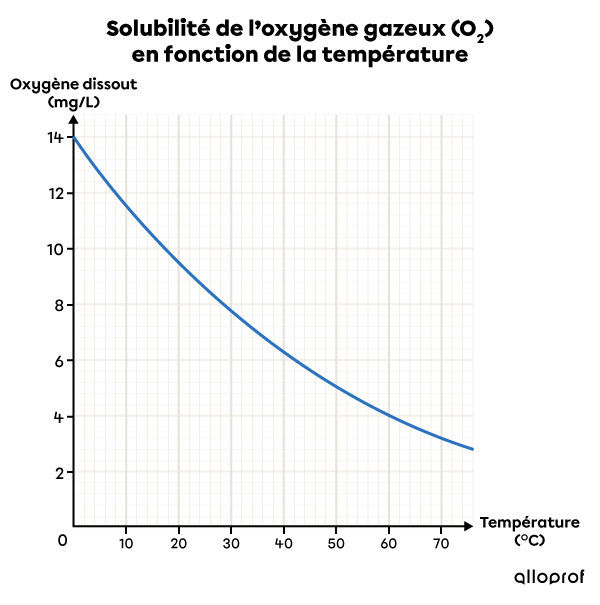
Source des données : Watterman, Adami, 2005.
Ce graphique de solubilité montre que plus la température augmente, plus la solubilité de l’oxygène gazeux |(\text{O}_2)| dans l’eau diminue. Ainsi, l’eau froide est un meilleur solvant que l’eau chaude pour ce soluté.
Watterman, K.; Adami, R. (2005). Accelerated aging: Prediction of chemical stability of pharmaceuticals. International Journal of Pharmaceutics, 293(1-2), 101-125. https://www.sciencedirect.com/science/article/abs/pii/S0378517305000104…