Le modèle atomique simplifié représente l'atome avec le nombre de protons et de neutrons dans le noyau, ainsi que le nombre d'électrons sur chacune des couches électroniques.

- L’atome est représenté par un espace presque vide avec, au centre, un noyau dense contenant les protons et les neutrons.
- Le nombre de neutrons est calculé en faisant la différence entre la masse atomique et le numéro atomique de l’élément.
- Un atome neutre possède autant d’électrons que de protons.
- Les électrons circulent autour du noyau de l’atome sur les couches électroniques.
Pour situer le modèle atomique simplifié dans son contexte historique et en savoir davantage sur les différents modèles atomiques, consulte la fiche sur l’histoire du modèle atomique.
Pour représenter un atome selon le modèle atomique simplifié, il faut dessiner le noyau en y indiquant son nombre de protons et de neutrons et dessiner le bon nombre d’électrons sur chaque couche électronique en suivant ces 4 étapes :
Le nombre de protons d’un atome correspond à son numéro atomique (Z). On trouve cette information dans le tableau périodique. Pour indiquer le nombre de protons, il suffit de faire un cercle dans lequel on inscrit le numéro atomique, accompagné de « p+ », qui désigne le mot proton.
Le numéro atomique du fluor est 9. Il a donc 9 protons.

La masse atomique correspond au nombre de protons et de neutrons, qui sont les particules les plus massives de l’atome. Pour trouver le nombre de neutrons, il faut arrondir la masse atomique à l’unité, ce qui équivaut au nombre de masse, et en soustraire le numéro atomique, qui correspond au nombre de protons. On écrit ensuite le nombre de neutrons dans le cercle, accompagné de « n0 », qui désigne le mot neutron.
|\text{N = A - Z}|
où
|\text{N}| représente le nombre de neutrons
|\text{A}| représente le nombre de masse
|\text{Z}| représente le numéro atomique, ou le nombre de protons
La masse atomique du fluor est de 18,998. On l’arrondit à l’unité, ce qui donne un nombre de masse de 19.
Le numéro atomique du fluor est 9.
|\text{N = A - Z}|
|\text{N} =19-9|
|\text{N} =10|
Il y a 10 neutrons dans le noyau d’un atome de fluor.

Le nombre d’électrons, dans un atome neutre, est égal au nombre de protons. Il est donc équivalent au numéro atomique.
Le fluor a 9 protons. Comme il est neutre, il a aussi 9 électrons.
Lors de la répartition des électrons sur les couches électroniques, il faut respecter les mêmes règles que pour le modèle atomique de Rutherford-Bohr, soit les 3 règles suivantes :
- La première couche contient un maximum de deux électrons.
- Les couches suivantes contiennent chacune un maximum de 8 électrons. Ceci est valide pour les éléments de numéro atomique inférieur ou égal à 20.
- Toutes les couches doivent être remplies au maximum, à l’exception de la dernière, qui peut être incomplète.
On distribue les électrons en remplissant d’abord la couche électronique la plus près du noyau, puis en continuant avec les 2e, 3e et 4e couches, s’il y a lieu. Il est important de respecter le nombre maximal permis pour chaque couche électronique.
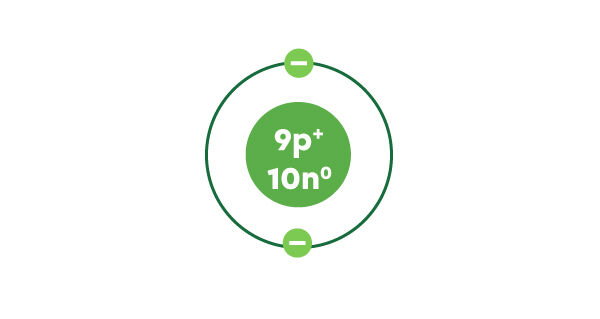
Le fluor a 9 électrons en tout et la première couche électronique peut contenir un maximum de 2 électrons. On dessine donc 2 électrons sur cette première couche et il en reste 7 à placer.
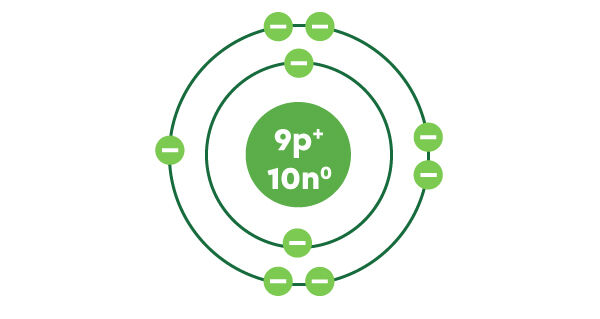
La deuxième couche contient un maximum de 8 électrons. On peut y placer les 7 électrons restants. Les 9 électrons du fluor sont maintenant représentés.
Lorsque les atomes ont beaucoup d’électrons, la représentation peut devenir chargée. Il est possible de dessiner les atomes selon le modèle atomique simplifié de manière abrégée.
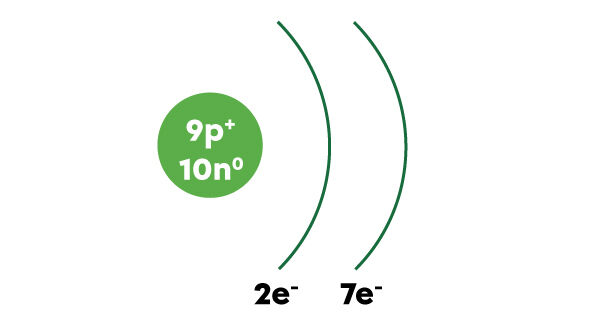
Il suffit de dessiner le noyau avec le nombre de protons et le nombre de neutrons et de dessiner des arcs de cercle à droite du noyau pour représenter les couches électroniques. On inscrit le nombre d’électrons sur chaque couche électronique sous la couche correspondante et on ajoute le symbole « e- » pour électron.
Voici la représentation abrégée du modèle atomique simplifié pour le fluor.
Bensaada, A., Bolduc, A., Claude, V., Meziane, M., Rhéaume, C. et Tardif, K. (2012). Kaléidoscope ST-STE - 2e cycle (2e année) (2e éd.). Chenelière Éducation.
APS Physics. (2007, mai) May 1932: Chadwick reports the discovery of the neutron.
Couture, I. et Peyronnet, O. (2009). Synergie, 2e cycle (2e année). [Manuel de l'élève]. Chenelière Éducation.