Choisis ton niveau.
L’atome est une particule de matière invisible à l’œil nu. Il est l’unité de base de la molécule.
Puisque les atomes sont invisibles à l’œil nu, il a fallu beaucoup de temps avant de démontrer leur existence et de déterminer leurs caractéristiques.
La plus vieille référence à l’atome répertoriée à travers l’histoire est attribuée au philosophe indien Kanad qui, vers l’an -600, émet l’hypothèse de l’existence de particules indivisibles appelées anu. Vers -400, le philosophe grec Démocrite parle également de particules indivisibles qu’il nomme atomos.
Au 18e siècle, le chimiste anglais John Dalton élabore un modèle de l’atome basé sur des données expérimentales. C’est ce qu’on appelle le modèle atomique de Dalton. Bien que ce modèle comporte quelques erreurs, il a permis de comprendre beaucoup de choses sur les caractéristiques de l’atome et sur les réactions chimiques.
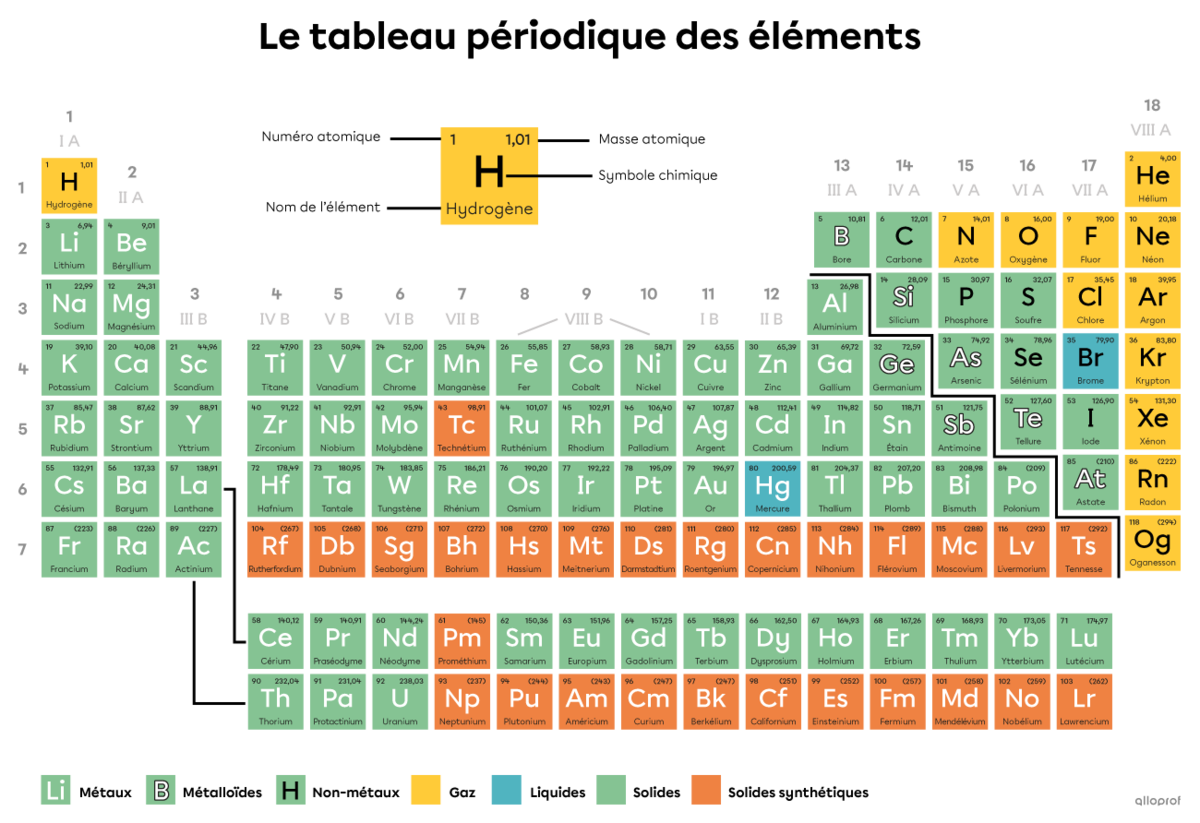
On connait aujourd’hui 118 sortes d’atomes différents. Ils sont classés dans un tableau organisé appelé tableau périodique des éléments.
Contrairement à ce que pensait John Dalton au début du 19e siècle, l’atome est divisible. Il comprend des particules subatomiques : les protons, les électrons et les neutrons. Selon la sorte d’atome, le nombre de chacune de ses particules subatomiques varie.
En découvrant peu à peu la composition de l’atome, de nombreux modèles atomiques ont été élaborés au 20e siècle. En voici quelques exemples.
D’autres modèles élaborés par la suite ont démontré que les protons et les neutrons sont également divisibles, et comprennent des particules encore plus petites.
Pour valider ta compréhension à propos de l’organisation de la matière de façon interactive, consulte la MiniRécup suivante.

L’atome est une particule de matière invisible à l’œil nu. Il est l’unité de base de la molécule, et des composés en général.
À travers l’histoire, de nombreux modèles atomiques ont été élaborés afin d’expliquer les caractéristiques des atomes. Grâce à ces modèles, on sait que les atomes peuvent se lier entre eux afin de former différents types de substances telles que des éléments polyatomiques, des molécules ou des composés. On sait également que les atomes sont divisibles et qu’ils comprennent des particules subatomiques.
On connait aujourd’hui 118 sortes d’atomes différents. Ils sont classés dans un tableau organisé appelé tableau périodique des éléments.
Les particules subatomiques sont des particules dont la taille est inférieure à celle d’un atome.
Contrairement à ce que pensait John Dalton au début du 19e siècle, l’atome est divisible. Il comprend des particules subatomiques.
Selon la sorte d’atome, le nombre de chacune de ses particules subatomiques varie.
Les électrons ne sont pas divisibles. On dit alors que ce sont des particules élémentaires. Par contre, les protons et les neutrons sont effectivement divisibles et sont composés de quarks. Il existe plusieurs types de quarks : les quarks up, les quarks down, les quarks strange, etc. Ils se distinguent par leur charge.
Les protons comprennent 3 quarks : 2 quarks up (de charge |\dfrac{2}{3}+|) et 1 quark down (de charge |\dfrac{1}{3}-|). La somme des charges de tous ces quarks donne une valeur de |1+,| ce qui correspond à la charge d’un proton.
Les neutrons comprennent également 3 quarks : 2 quarks down et 1 quark up. La somme des charges de tous ces quarks donne une valeur de |0,| ce qui correspond à la charge d’un neutron.
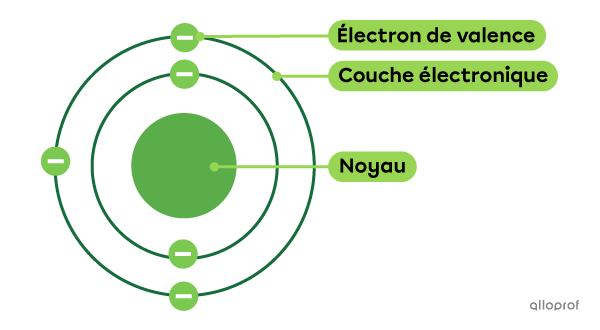
Les électrons sont des particules de charge négative qui se trouvent autour du noyau de l’atome.
C’est au début du 20e siècle que John Thomson démontre l’existence des électrons et identifie plusieurs de leurs caractéristiques. Par la suite, les expériences de Niels Bohr permettent d’élaborer un modèle selon lequel les électrons se trouvent sur des couches électroniques.
Les électrons se trouvant sur la couche électronique la plus éloignée du noyau sont appelés électrons de valence. Ils permettent aux atomes de se lier grâce à des liaisons chimiques.
Le tableau suivant présente plusieurs caractéristiques des électrons.
| Symbole | Charge | Masse[1] |
|---|---|---|
| |\text{e}^-| | |1-| | |9{,}109\times10^{-31}\ \text{kg}| |
Puisqu’un atome est neutre, il comprend le même nombre de protons que d’électrons.
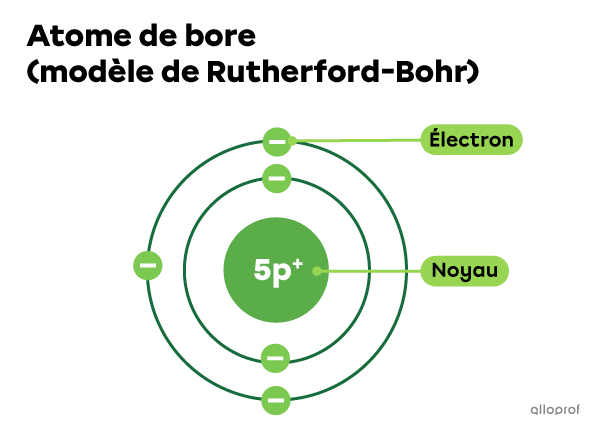
L’atome de bore |(\text{B})| comprend 5 protons dans son noyau. Puisqu’il est neutre, on peut aussi dire que cet atome comprend 5 électrons.
Au début du 20e siècle, les scientifiques sont persuadés que les électrons sont uniquement des particules. Ceci dit, les travaux de Louis de Broglie, Clinton Davisson, Lester Germer et de nombreux autres contributeurs ont su démontrer que les électrons sont non seulement capables de se comporter comme des particules, mais aussi comme des ondes! On dit alors que les électrons ont une double nature : une nature particulaire et une nature ondulatoire.
Cette découverte donne naissance au modèle quantique de l’atome. Dans ce modèle, les électrons ne se trouvent pas sur une orbite circulaire, comme c’est le cas dans le modèle de Rutherford-Bohr. Les électrons se trouvent plutôt dans des zones de probabilité appelées orbitales, et ces orbitales peuvent avoir plusieurs formes et tailles différentes.

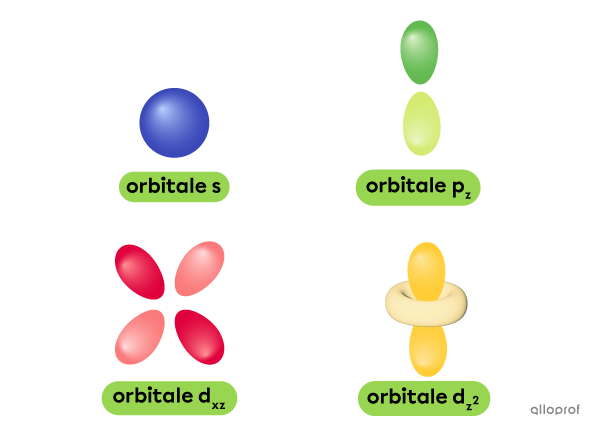
Les protons sont des particules de charge positive qui constituent le noyau de l’atome.
Au début du 20e siècle, John Thomson émet l’hypothèse de l’existence des protons. Ceci dit, c’est Ernest Rutherford qui a permis de démontrer leur existence et d’identifier plusieurs de leurs caractéristiques.
Puisqu’on trouve des protons dans le noyau de l’atome, on dit que les protons sont des nucléons.
Le tableau suivant présente plusieurs caractéristiques des protons.
| Symbole | Charge | Masse[2] |
|---|---|---|
| |\text{p}^+| | |1+| | |1{,}673\times10^{-27}\ \text{kg}| |
Dans le tableau périodique des éléments, le numéro atomique |(\text{Z})| inscrit dans la case d’un atome correspond à son nombre de protons. C’est justement le nombre de protons présents dans le noyau d’un atome qui détermine son identité.
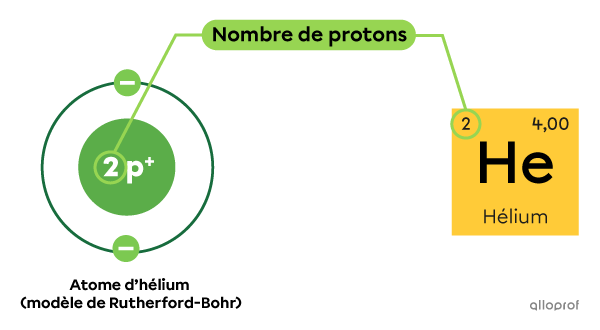
Tous les atomes d’hélium |(\text{He})| comprennent 2 protons dans leur noyau.
Tel qu’indiqué dans le tableau périodique, le numéro atomique |(\text{Z})| de l’hélium est 2.
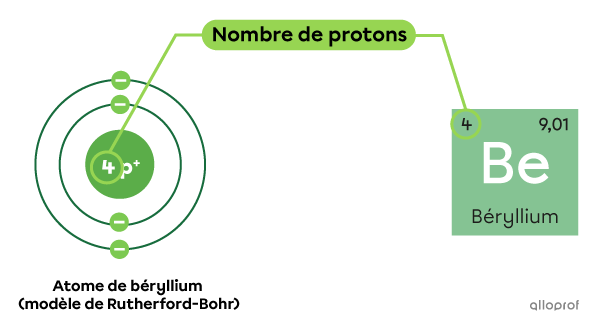
Un atome comprend 4 protons dans son noyau. De quel atome s’agit-il?
Un atome qui comprend 4 protons dans son noyau est l’atome numéro 4 dans le tableau périodique. Il s’agit donc du béryllium |(\text{Be}).|
Avec les neutrons, les protons contribuent de façon significative à la masse atomique des éléments.
Les neutrons sont des particules neutres qui se trouvent dans le noyau de l’atome.
La découverte des neutrons a pu se faire grâce à de multiples expériences sur la radioactivité. C’est finalement en 1932 que James Chadwick révise le modèle atomique pour y inclure la présence des neutrons au sein du noyau de l’atome. Les neutrons se lient aux protons afin de stabiliser le noyau en diminuant l’effet de la force de répulsion entre les protons.
Puisqu’on peut trouver des neutrons dans le noyau de l’atome, on dit que les neutrons sont des nucléons.
Parmi tous les éléments du tableau périodique, seul le noyau de l’atome d’hydrogène |(_{1}^{1}\text{H})| ne comprend pas de neutron.
Le tableau suivant présente plusieurs caractéristiques des neutrons.
| Symbole | Charge | Masse[3] |
|---|---|---|
| |\text{n}^0| | |0| | |1{,}675\times10^{-27}\ \text{kg}| |
Contrairement au nombre de protons |(\text{Z}),| le nombre de neutrons |(\text{N})| présents dans le noyau d’un atome n’est pas indiqué dans le tableau périodique. Par contre, il peut se calculer à partir du nombre de masse |(\text{A}).|
Avec les protons, les neutrons contribuent de façon significative à la masse atomique des éléments.
Ce bloc n'est nécessaire qu'en anglais.
-
The National Institute of Standards and Technology. (2018). Fundamental Physical Constants - Electron mass. https://www.physics.nist.gov/cgi-bin/cuu/Value?me|search_for=electron+m…
-
The National Institute of Standards and Technology. (2018). Fundamental Physical Constants - Proton mass. https://www.physics.nist.gov/cgi-bin/cuu/Value?mp|search_for=proton+mass
-
The National Institute of Standards and Technology. (2018). Fundamental Physical Constants - Neutron mass. https://www.physics.nist.gov/cgi-bin/cuu/Value?mn|search_for=neutron+ma…