Cette fiche explique les manipulations à suivre pour neutraliser une substance (acide ou basique).
<!DOCTYPE html PUBLIC "-//W3C//DTD HTML 4.0 Transitional//EN" "http://www.w3.org/TR/REC-html40/loose.dtd">
<html><body><p>La <a href="/fr/eleves/bv/sciences/la-neutralisation-acidobasique-s1068">neutralisation acidobasique</a> représente la réaction entre un acide et une base. Cette réaction permet de produire deux substances, soit un sel et de l'eau. De plus, il est possible d'identifier la concentration de l'acide ou de la base à partir des données expérimentales. Le titrage permet, quant à lui, de déterminer la concentration d'un soluté dans une solution à partir d'une autre solution dont la concentration est déjà connue. Une neutralisation est un exemple de titrage acidobasique.</p>
<p>La technique utilisée pour la neutralisation et celle pour le titrage sont semblables. Seules les substances utilisées changent selon le type de réaction effectué. Les deux techniques nécessitent un indicateur pour permettre l'observation d'un changement de couleur indiquant que la réaction est complète.</p>
<p>Dans cette fiche, le titrage acidobasique sera expliqué.</p>
</body></html>
- Cylindre gradué
- Burette
- Support à burette
- Support universel
- Erlenmeyer
- Solution à neutraliser
- Solution neutralisante
- Indicateur acidobasique
- Bécher
- Tablier ou sarrau
- Lunettes de sécurité

Puisque le pH désiré pour la neutralisation est 7, l'indicateur privilégié pour ce laboratoire sera le bleu de bromothymol, puisque le point de virage se situe entre 6,0 et 7,6. Toutefois, le choix de l'indicateur revient à la personne qui fait le laboratoire en fonction du but de l'expérience. La fiche suivante permet de donner des exemples d'indicateurs pouvant être utilisés.
Les indicateurs acidobasiques
1. Mesurer un certain volume de la solution à neutraliser à l'aide du cylindre gradué.

2. Verser le liquide mesuré à l'étape précédente dans l'erlenmeyer.
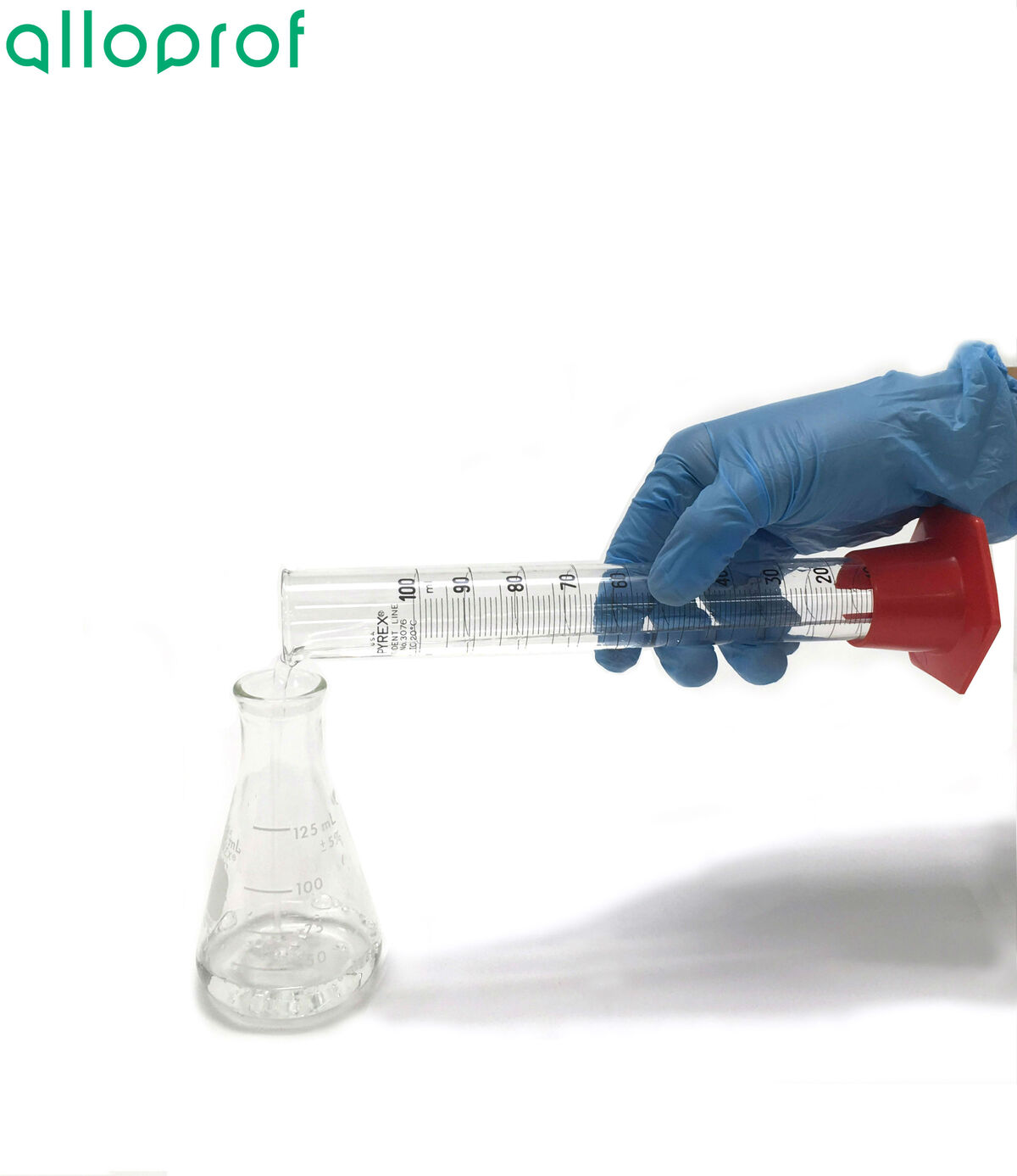
3. Ajouter quelques gouttes de l'indicateur dans l'erlenmeyer.

La couleur de la solution permet d'indiquer la nature de la solution obtenue. Par exemple, pour le bleu de bromothymol, une coloration jaune indique que la solution est acide: elle doit donc être neutralisée par une base. Une coloration bleue dans l'erlenmeyer indique que la solution est basique et que la solution neutralisante doit être acide.


La quantité d'indicateur à ajouter dépend du titrage effectué. De manière générale, lorsqu'on utilise 10 ml de la solution à neutraliser, de quatre à cinq gouttes d'indicateur sont nécessaires pour observer adéquatement le changement de couleur indiquant que la réaction est complète.
4. Installer le support à burette sur le support universel, et la burette dans le support à burette.

5. Remplir la burette à ras bord de la solution neutralisante.
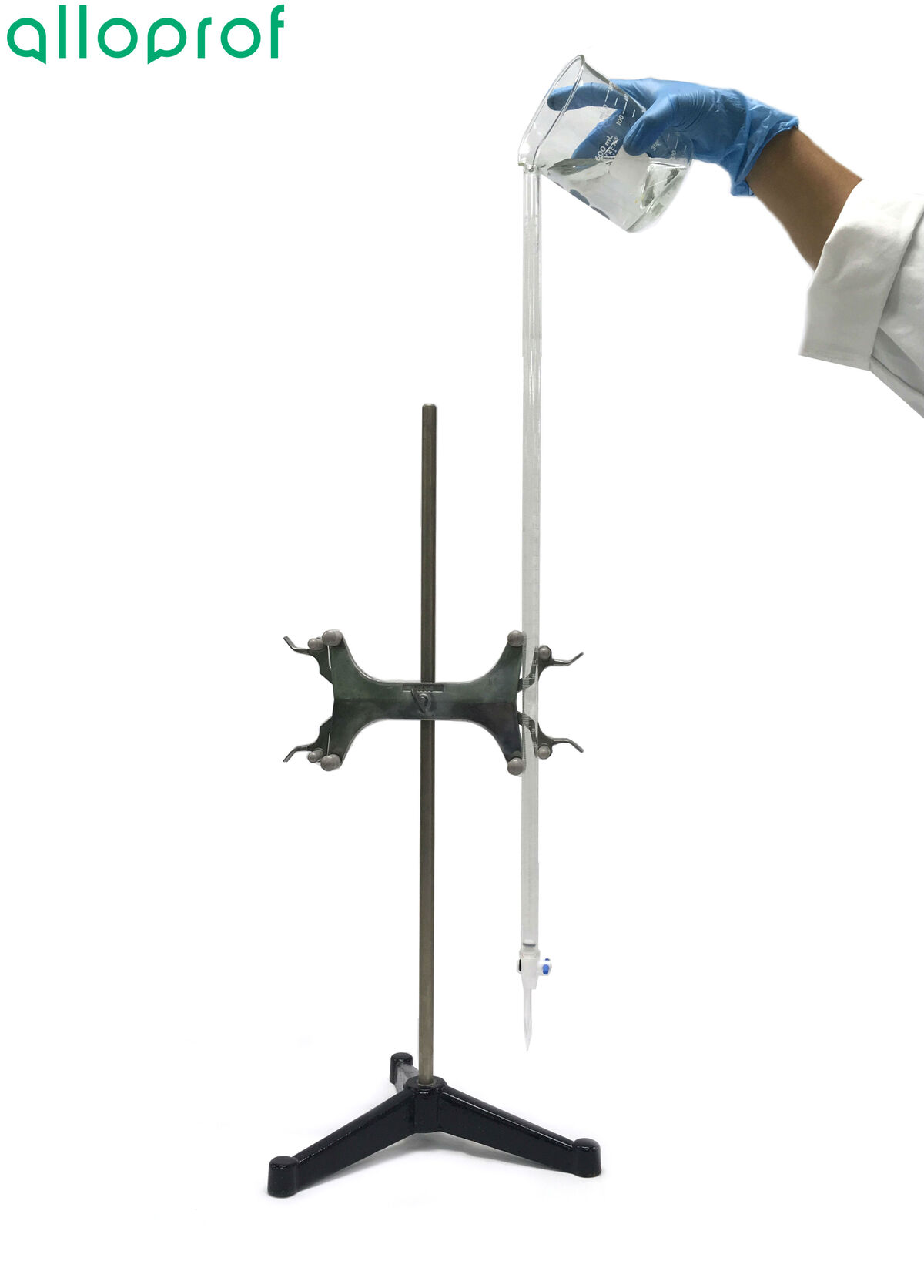
6. Placer un bécher sous le robinet de la burette.

7. Ouvrir le robinet de la burette afin de bien remplir la partie sous le robinet et d'ajuster le volume de la burette à zéro.

8. Placer l'erlenmeyer sous la burette.

9. En ouvrant tranquillement le robinet de la burette, laisser couler lentement la solution neutralisante dans la solution à neutraliser de l'erlenmeyer tout en agitant doucement l'erlenmeyer.

10. Lorsque la solution contenue dans l'erlenmeyer change de couleur de façon persistante à l'endroit où la solution neutralisante entre en contact avec la solution à neutraliser, fermer le robinet de manière à ralentir le débit d'écoulement de la solution neutralisante.

11. Ajouter la solution neutralisante goutte à goutte en brassant continuellement jusqu'à ce que la coloration soit constante.

La coloration recherchée dépend de l'indicateur utilisé. Dans le cas du bleu de bromothymol, la couleur que l'on doit obtenir est entre le jaune de la solution acide et le bleu de la solution basique: la solution doit donc être verte pour atteindre une neutralisation complète.
12. Noter le volume de la solution neutralisante utilisée.

13. Calculer la concentration de la solution à neutraliser.
14. Nettoyer et ranger le matériel.
Si c'est possible, il est recommandé de refaire l'expérience une deuxième fois afin de valider les résultats expérimentaux obtenus la première fois.
Pour trouver la concentration de la solution à neutraliser, il faut utiliser les données expérimentales.
Quelle est la concentration d'un échantillon de |\small 50,0 \: \text {ml}| d'une solution à neutraliser si on utilise |\small 29,5 \: \text {ml}| d'une solution neutralisante dont la concentration est |\small 0,0150 \: \text {mol/L}| ?
Il faut tout d'abord identifier les variables dans cette situation.
||\begin{align}C_{1} &= x & &\quad & C_{2} &= 0,0150\: \text{mol/L}\\
V_{1} \: &= \: 50,0 \: \text{ml} &&& V_{2} &= \: 29,5 \: \text{ml} \end{align}||
Puisqu'il n'y a qu'une seule variable inconnue, elle peut être déterminée mathématiquement.
||\begin{align} C_1\times V_1=C_2\times V_2 \quad \Rightarrow \quad C_1 &=\displaystyle\frac{C_2 \times V_2}{V_1}
\\ \\
&= \displaystyle\frac{0,0150\: \text{mol/L} \times 29,5 \:\text{mL}}{50,0\: \text{mL}}\\ \\
&= 0,00885 \:\text{mol/L}\end{align}||
La concentration de la solution à neutraliser est donc |0,00885 \:\text{mol/L}|.
<!DOCTYPE html PUBLIC "-//W3C//DTD HTML 4.0 Transitional//EN" "http://www.w3.org/TR/REC-html40/loose.dtd">
<html><body><p>Il est important de présenter les valeurs expérimentales dans un tableau. Voici un modèle de tableau de résultats pour le titrage acidobasique.</p>
<p style="text-align:center;"><strong>Titrage acidobasique d'une solution</strong></p>
<table cellspacing="0" class="ms-rteTable-bv-simpletableau" style="height:107px;text-align:center;" width="100%">
<tbody>
<tr class="ms-rteTableEvenRow-bv-simpletableau">
<td class="ms-rteTableEvenCol-bv-simpletableau" style="width:25%;"></td>
<td class="ms-rteTableOddCol-bv-simpletableau" style="width:25%;"><strong>Solution à neutraliser</strong></td>
<td class="ms-rteTableEvenCol-bv-simpletableau" colspan="1" style="width:25%;"></td>
<td class="ms-rteTableOddCol-bv-simpletableau" colspan="1" style="width:25%;"><strong>Solution neutralisante</strong></td>
</tr>
<tr class="ms-rteTableOddRow-bv-simpletableau">
<td class="ms-rteTableEvenCol-bv-simpletableau" style="width:25%;">|C_1|</td>
<td class="ms-rteTableOddCol-bv-simpletableau" style="width:25%;">|0,00885 \: \text {mol/L}|</td>
<td class="ms-rteTableEvenCol-bv-simpletableau" colspan="1" style="width:25%;">|C_2|</td>
<td class="ms-rteTableOddCol-bv-simpletableau" colspan="1" style="width:25%;">|0,0150 \: \text {mol/L}|</td>
</tr>
<tr class="ms-rteTableEvenRow-bv-simpletableau">
<td class="ms-rteTableEvenCol-bv-simpletableau" style="width:25%;">|V_1|</td>
<td class="ms-rteTableOddCol-bv-simpletableau" style="width:25%;">|50,0 \: \text { ml}|</td>
<td class="ms-rteTableEvenCol-bv-simpletableau" colspan="1" style="width:25%;">|V_2|</td>
<td class="ms-rteTableOddCol-bv-simpletableau" colspan="1" style="width:25%;">|29,5 \: \text {ml}|</td>
</tr>
</tbody>
</table>
<p>Dans certains contextes, comme dans la stoechiométrie, il peut être nécessaire de calculer le nombre de moles de la solution à neutraliser. Il faut donc utiliser la formule de <a href="/fr/eleves/bv/sciences/la-concentration-et-ses-unites-de-mesure-s1028#la-concentration-molaire">la concentration molaire</a> pour déterminer le nombre de moles. Il pourrait également être possible de déterminer <a href="/fr/eleves/bv/sciences/le-ph-et-l-echelle-ph-s1038">le pH</a> des solutions initiales en utilisant les équations de dissociation.</p>
</body></html>