<!DOCTYPE html PUBLIC "-//W3C//DTD HTML 4.0 Transitional//EN" "http://www.w3.org/TR/REC-html40/loose.dtd">
<html><body><p>L’énergie ne se perd pas, elle se transforme: c'est la <a href="/fr/eleves/bv/sciences/la-conservation-de-l-energie-s1090">loi de la conservation de l'énergie</a>. Elle peut changer de forme indéfiniment, car elle se transforme au gré des <a href="/fr/eleves/bv/sciences/les-transferts-et-les-transformations-d-energie-s1089">transferts d’énergie</a>. Lors de ces nombreux échanges d’énergie, il y a des réactions qui dégagent de l’énergie et d’autres qui en absorbent.</p>
</body></html>
Les réactions exothermiques sont des réactions qui dégagent de l’énergie, augmentant ainsi le degré énergétique de leur milieu. Cela peut être perceptible par une augmentation de température ou dégagement de lumière.
Lorsqu’une réaction chimique dégage de la chaleur dans un milieu, la température de ce milieu augmente. La température finale est donc plus élevée que la température initiale.
On reconnaît une réaction exothermique lorsque, dans une équation chimique, la valeur énergétique est intégrée du côté des produits de la réaction, à droite de la flèche.
|N_{2(g)} + 3 \space H_{2(g)} \rightarrow 2 \space NH_{3(g)} + 95,4 kJ|
On peut également écrire cette réaction en écrivant l'énergie à l'extérieur de l'équation chimique. Toutefois, la variation d’énergie, écrit sous la forme de variation d'enthalpie |(\triangle H)| est par convention précédée du signe négatif (-). Le signe négatif indique qu'il y a une perte d'énergie.
|N_{2(g)} + 3 \space H_{2(g)} \rightarrow 2 \space NH_{3(g)} \space \space \triangle H = - 95,4 kJ|
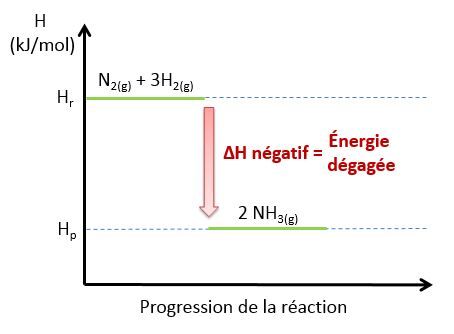
Voici un diagramme représentant la réaction exothermique de la synthèse de l’ammoniac |(NH_{3})| et l’évolution de l’énergie lors de cette réaction.
<!DOCTYPE html PUBLIC "-//W3C//DTD HTML 4.0 Transitional//EN" "http://www.w3.org/TR/REC-html40/loose.dtd">
<html><body><p>Le graphique précédent illustre une réaction exothermique, car l'enthalpie des produits est à un niveau plus bas que l'enthalpie des réactifs.</p>
<p>Il existe plusieurs exemples de réactions exothermiques en chimie. La majorité des <a href="/fr/eleves/bv/sciences/la-combustion-et-le-triangle-de-feu-s1065">combustions</a>, lentes ou rapides, et les <a href="/fr/eleves/bv/sciences/la-neutralisation-acidobasique-s1068">réactions de neutralisation</a> sont des réactions exothermiques.</p>
</body></html>
Les réactions endothermiques sont des réactions qui, en absorbant de l’énergie, abaissent le degré énergétique du milieu. Cela peut être perceptible par une baisse de température dans le milieu.
Lorsqu’une réaction chimique absorbe de la chaleur dans un milieu, la température de ce milieu diminue. La température finale est donc moins élevée que la température initiale. C’est donc le milieu environnant qui est responsable de ce transfert d’énergie.
On reconnaît une réaction endothermique lorsque, dans une équation chimique, la valeur énergétique est intégrée du côté des réactifs de l’équation (à gauche de la flèche).
|2 \space NH_{3(g)} + 95,4 kJ \rightarrow N_{2(g)} + 3 \space H_{2(g)}|
On peut également écrire cette réaction en écrivant l'énergie à l'extérieur de l'équation chimique. La variation d'énergie, ou variation d’enthalpie |(\triangle H)|, est par convention précédée du signe positif (+), signe qui indique qu'il y a un gain d'énergie.
|2 \space NH_{3(g)} \rightarrow N_{2(g)} + 3 \space H_{2(g)} \space \space \triangle H = + 95,4 kJ|
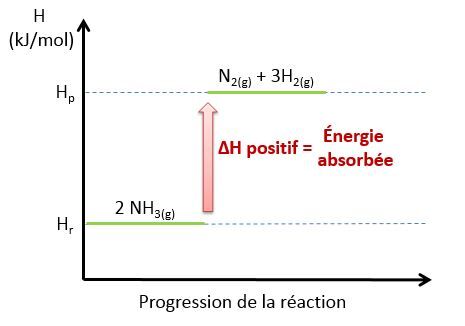
Voici un diagramme représentant la réaction endothermique de la décomposition de l’ammoniac et l’évolution de l’énergie lors de cette réaction.
<!DOCTYPE html PUBLIC "-//W3C//DTD HTML 4.0 Transitional//EN" "http://www.w3.org/TR/REC-html40/loose.dtd">
<html><body><p><span><span>Le graphique précédent illustre une réaction endothermique, car l'enthalpie des réactifs est à un niveau plus bas que l'enthalpie des produits.</span></span><br>
Il existe plusieurs exemples de réactions endothermiques, notamment la majorité des décompositions chimiques, que ce soit par l’apport de la chaleur, de la lumière ou de l’électricité (<a href="/fr/eleves/bv/chimie/l-electrolyse-de-l-eau-c1057">électrolyse</a>).</p>
</body></html>