Le modèle atomique de Rutherford-Bohr représente l’atome en indiquant le nombre de protons dans le noyau ainsi que le nombre d’électrons sur chacune des couches électroniques.
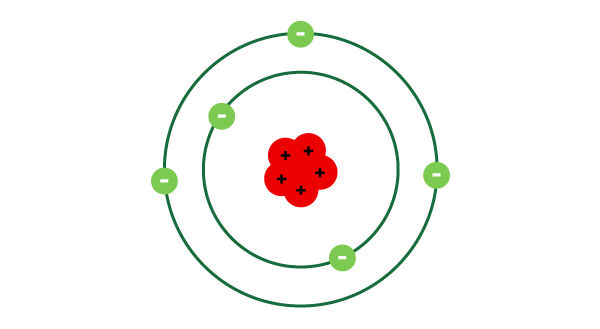
- L’atome est représenté par un espace presque vide avec, au centre, un noyau massif et dense contenant les protons.
- Les électrons circulent autour du noyau de l’atome sur des couches électroniques.
- Il peut y avoir plus d’un électron par couche électronique.
- Un atome électriquement neutre possède autant d’électrons que de protons.
- Le nombre de protons et d’électrons correspond au numéro atomique de l’élément.
Pour situer le modèle atomique de Rutherford-Bohr dans son contexte historique et en savoir davantage sur les différents modèles atomiques, consulte la fiche sur l’histoire du modèle atomique.
Pour représenter un atome selon le modèle de Rutherford-Bohr, il faut dessiner le noyau en y indiquant le nombre de protons et dessiner le bon nombre d’électrons sur chaque couche électronique en suivant ces 4 étapes :
Le nombre de protons d’un atome correspond à son numéro atomique (Z). On retrouve cette information dans le tableau périodique.
Les protons sont situés dans le noyau d’un atome. Pour dessiner le noyau, il suffit de faire un cercle dans lequel on inscrit le nombre de protons, c’est-à-dire le numéro atomique, accompagné de « p+ », qui désigne le mot proton.
Le numéro atomique du bore est 5. Son noyau contient donc 5 protons.

Le nombre d’électrons, dans un atome électriquement neutre, est égal au nombre de protons. Il est donc équivalent au numéro atomique.
Le bore a 5 protons. Comme il est neutre, il a aussi 5 électrons.
On distribue les électrons en remplissant d’abord la couche la plus près du noyau, puis en continuant avec les couches suivantes.
Il y a 3 règles à respecter lors de la répartition des électrons sur les couches électroniques :
- La première couche contient un maximum de 2 électrons.
- Les couches suivantes contiennent un maximum de 8 électrons (ceci est valide pour les éléments de numéro atomique inférieur ou égal à 20).
- Toutes les couches doivent être remplies au maximum, à l’exception de la dernière, la couche périphérique, qui peut être incomplète.
Le bore possède 5 électrons au total. La première couche électronique contient un maximum de 2 électrons. Ainsi, il reste 3 électrons à placer.
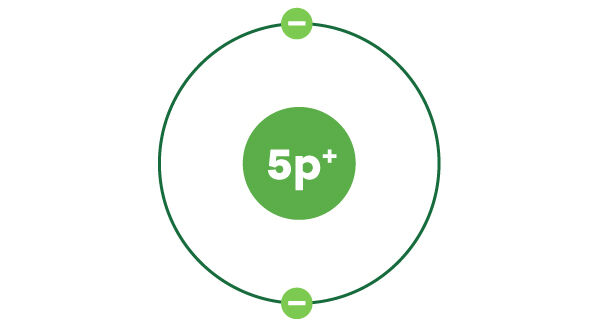
La deuxième couche contient un maximum de 8 électrons. On y place les 3 électrons restants.
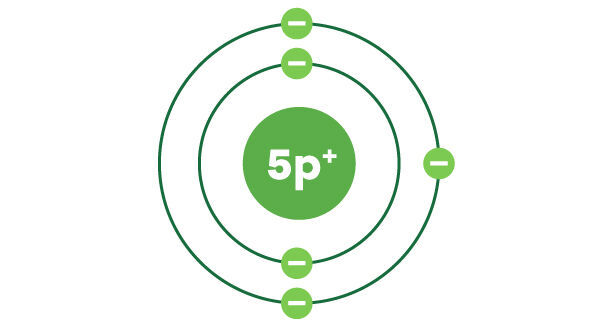
Sur la 1re couche électronique, on place habituellement le premier électron en haut du noyau et le deuxième électron en bas du noyau.
Sur la 2e couche électronique et les suivantes, on place les 4 premiers électrons en haut, à droite, en bas et à gauche du noyau. Les électrons restants sont distribués de façon à former des paires d’électrons, comme on le voit sur l'image.

Il est possible de vérifier si les électrons ont été correctement placés sur les couches électroniques en utilisant le tableau périodique. Le numéro de la période représente le nombre de couches électroniques de l'atome.
Le numéro de la famille, quant à lui, permet de déterminer le nombre d'électrons de valence, soit le nombre d'électrons situés sur la dernière couche électronique.
Pour valider ta compréhension à propos du tableau périodique de façon interactive, consulte la MiniRécup suivante :

Bensaada, A., Bolduc, A., Claude, V., Meziane, M., Rhéaume, C. et Tardif, K. (2012). Kaléidoscope ST-STE - 2e cycle (2e année) (2e éd.). Chenelière Éducation.
Couture, I. et Peyronnet, O. (2009). Synergie, 2e cycle (2e année). [Manuel de l'élève]. Chenelière Éducation.
Khan Academy. (2020). Découverte de l’électron et du noyau.
Doud, T. (2014, 08 décembre). The 2,400-year search for the atom [vidéo]. TED-Ed.