La notation de Lewis d’un atome est un modèle qui représente son symbole chimique ainsi que ses électrons de valence.
Afin de déterminer la notation de Lewis d’un atome, il faut déterminer son nombre d’électrons de valence et suivre des règles précises. La notation obtenue apporte des informations concernant les liaisons chimiques que cet atome peut faire avec un ou plusieurs autres atomes.
Les électrons de valence sont les électrons qui se trouvent sur la dernière couche électronique d’un atome.
On peut déterminer le nombre d’électrons de valence d’un atome en se référant au modèle atomique de Rutherford-Bohr : il suffit de dénombrer les électrons situés sur la dernière couche électronique, soit la couche la plus éloignée du noyau.
L’oxygène |(\text{O})| est un élément qui comprend un total de 8 électrons. Parmi ces 8 électrons, 6 d’entre eux se trouvent sur la dernière couche électronique. L’oxygène comprend donc 6 électrons de valence.
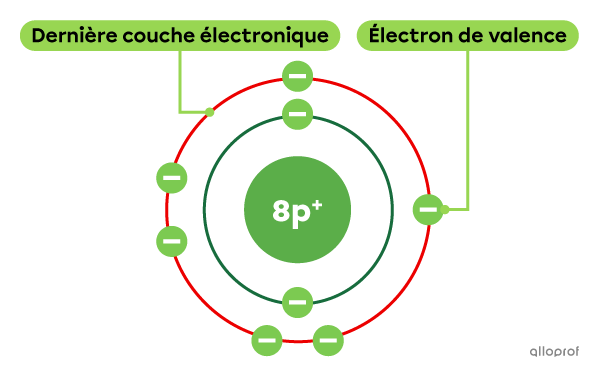
Le calcium |(\text{Ca})| est un élément qui comprend un total de 20 électrons. Parmi ces 20 électrons, 2 d’entre eux se trouvent sur la dernière couche électronique. Le calcium comprend donc 2 électrons de valence.
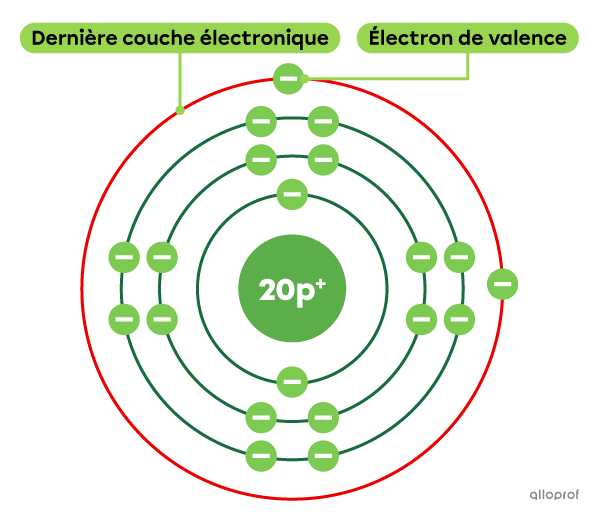
Pour déterminer le nombre d’électrons de valence d’un élément, on peut également se référer au tableau périodique.
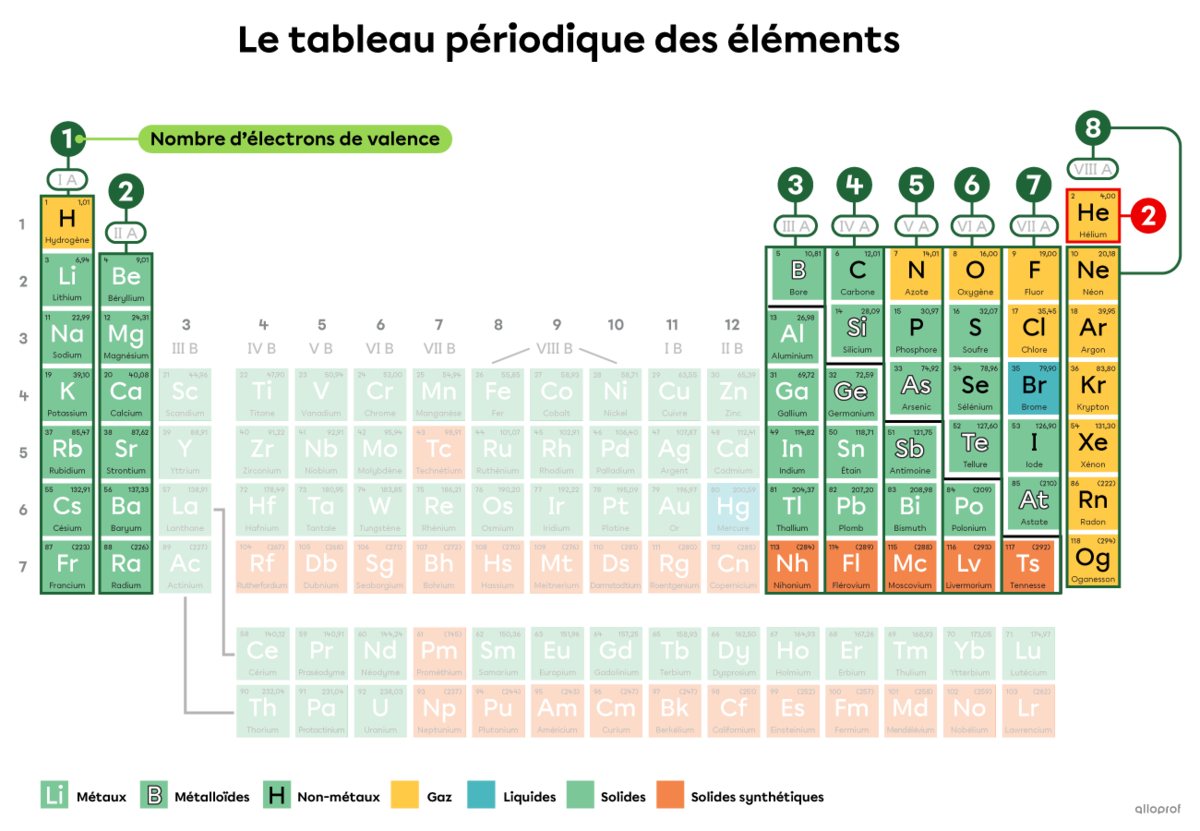
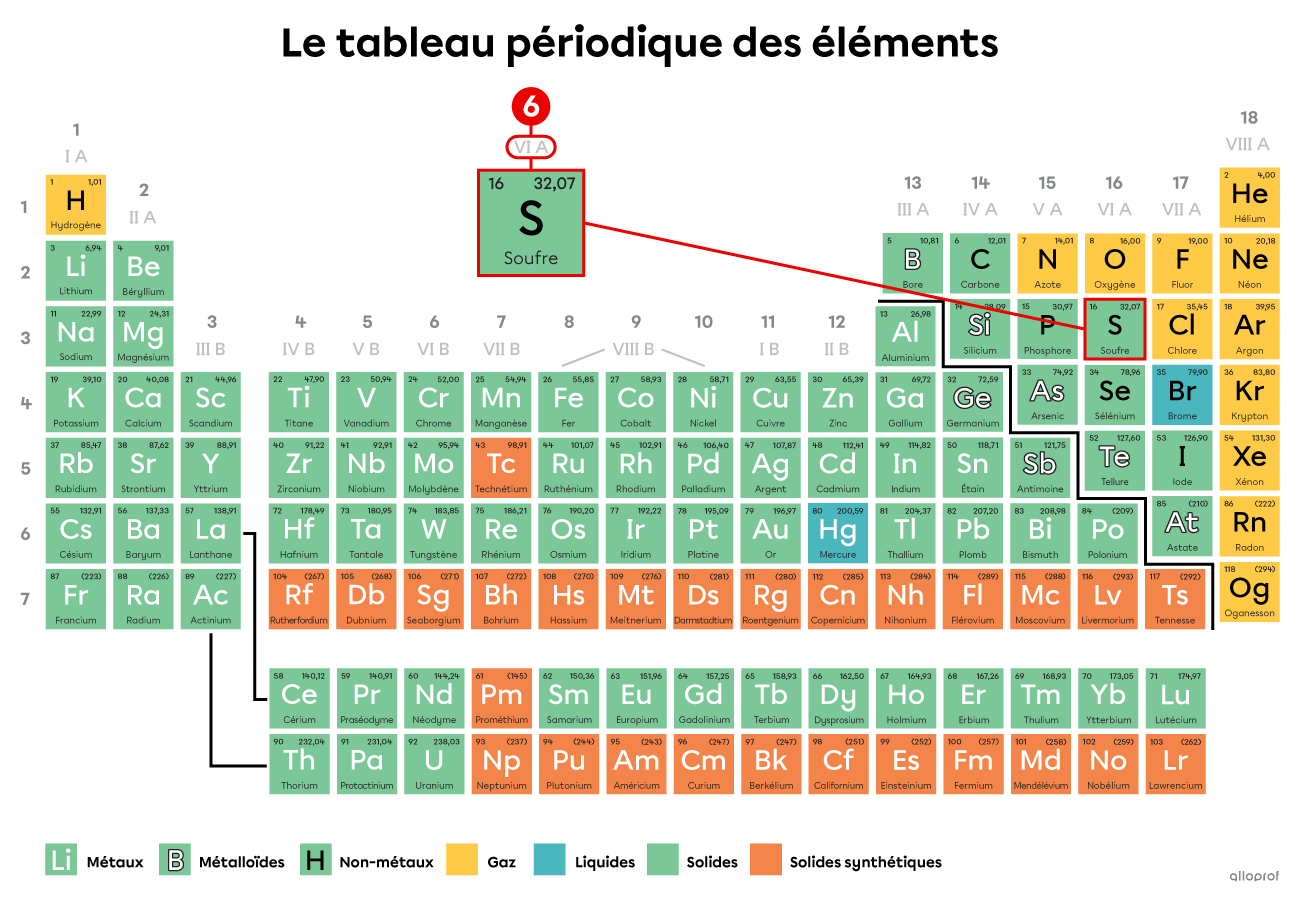
Dans le tableau périodique précédent, certains éléments sont mis en évidence. Le nombre d’électrons de valence de ces éléments correspond au numéro de la famille à laquelle ils appartiennent. Ainsi, les atomes de la famille IA ont 1 électron de valence. Les atomes de la famille IIA ont 2 électrons de valence. Les atomes de la famille IIIA en ont 3, et ainsi de suite.
L’hélium |(\text{He})| appartient à la famille VIIIA, mais il comprend seulement 2 électrons de valence.

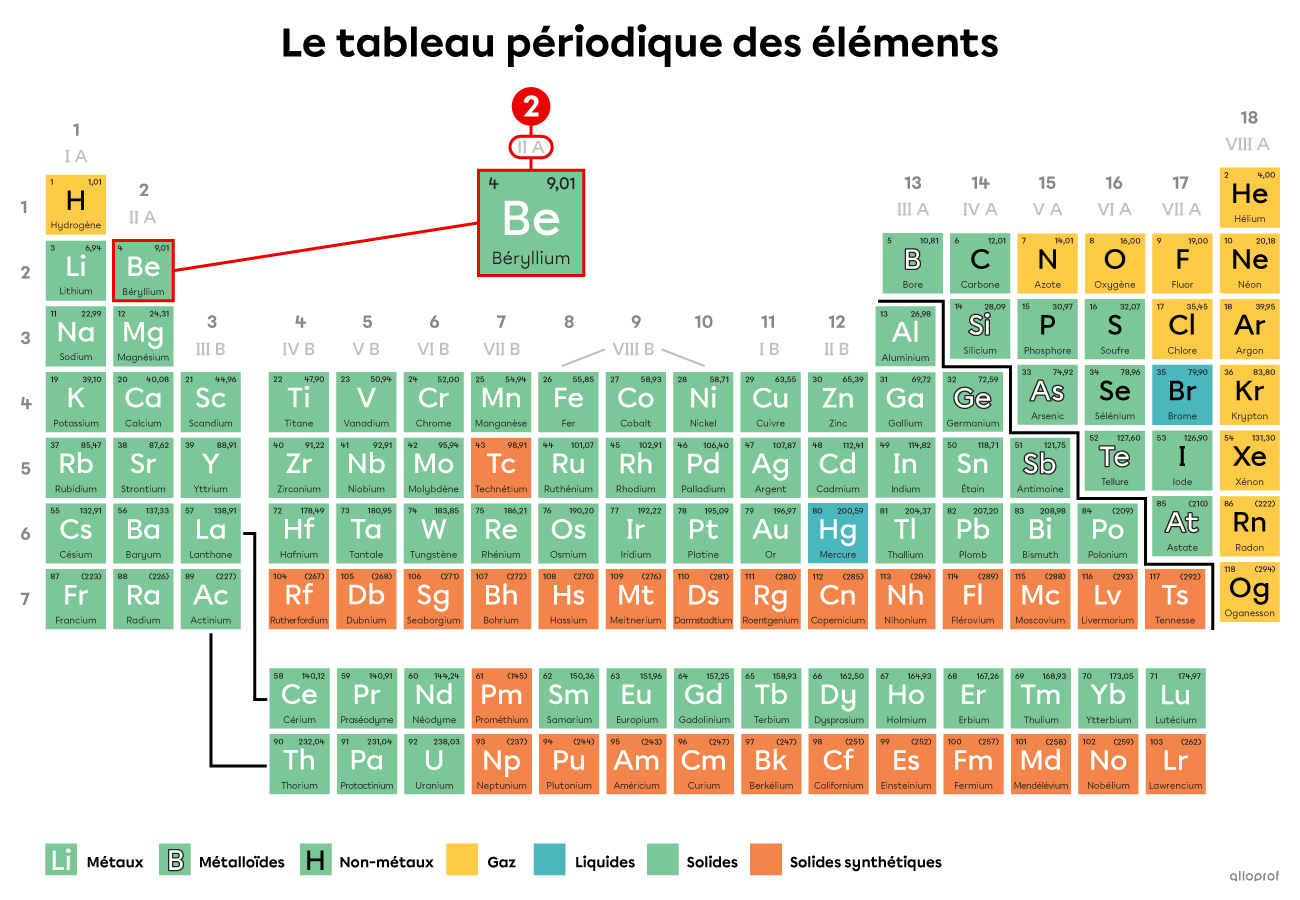
Quel est le nombre d’électrons de valence du béryllium |(\text{Be})|?
Le béryllium |(\text{Be})| appartient à la famille IIA. Il a donc 2 électrons de valence.
Quel est le nombre d’électrons de valence du soufre |(\text{S})|?
Le soufre |(\text{S})| appartient à la famille VIA. Il a donc 6 électrons de valence.
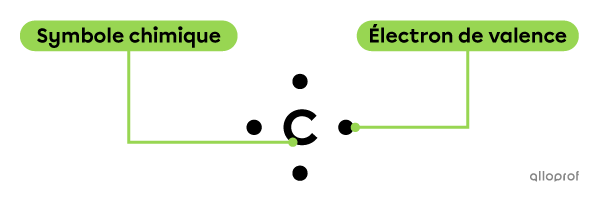
La notation de Lewis d’un atome donné comprend son symbole chimique ainsi que son ou ses électrons de valence, symbolisés par des points.
Les électrons de valence doivent être placés autour du symbole de l’atome en suivant des règles bien précises.
-
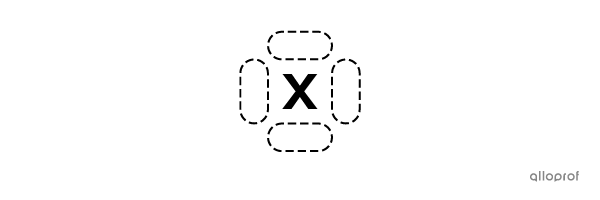
Le symbole chimique de l’atome possède quatre côtés où les électrons de valence peuvent être placés.
-
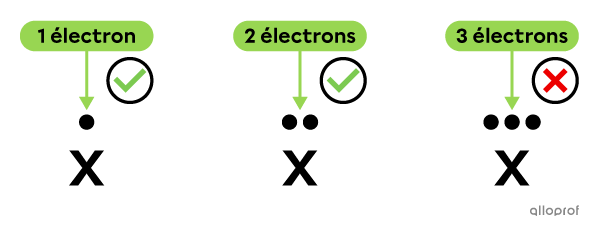
Chaque côté peut avoir un maximum de 2 électrons.
-
On distribue les électrons de valence un à la fois sur chaque côté, avant de les placer par paire.

L’hélium |(\text{He})| a 2 électrons de valence. Il fait exception à la dernière règle, car on doit placer ses 2 électrons ensemble de la façon suivante.

En représentant la notation de Lewis d’un atome, certains électrons peuvent se trouver en paires. Ces paires sont des doublets d’électrons. Lorsqu’au contraire, les électrons sont non pairés, on les qualifie d’électrons célibataires.
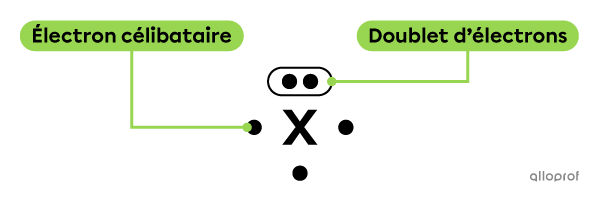
Il faut placer les doublets d’électrons de façon parallèle au côté sur lequel ils se trouvent.

Quelle est la notation de Lewis de l’atome d’aluminium |(\text{Al})|?
L’atome d’aluminium |(\text{Al})| fait partie de la famille IIIA. Il comprend donc 3 électrons de valence.
-
On commence par représenter le symbole chimique de cet élément, soit Al.
-
On place ses 3 électrons de valence un à la fois de chaque côté du symbole de l’atome afin d’obtenir sa notation de Lewis.
On remarque qu’il y a plusieurs notations possibles pour représenter l’aluminium. Dans tous les cas, on voit que l’aluminium a 3 électrons célibataires.

Attention aux erreurs communes!
-
Il ne faut pas regrouper les 3 électrons de valence sur un seul côté. En effet, selon les règles à suivre, chaque côté a un maximum de 2 électrons.

-
Il ne faut pas grouper les électrons tout de suite. Il faut les placer individuellement avant de les placer par paire.

Quelle est la notation de Lewis de l’atome de calcium |(\text{Ca})|?
L’atome de calcium |(\text{Ca})| fait partie de la famille IIA. Il comprend donc 2 électrons de valence.
-
On commence par représenter le symbole chimique de cet élément, soit Ca.
-
On place ses 2 électrons de valence un à la fois de chaque côté du symbole de l’atome afin d’obtenir sa notation de Lewis.
On remarque qu’il y a plusieurs notations possibles pour représenter le calcium. Dans tous les cas, on constate que le calcium a 2 électrons célibataires.

Attention aux erreurs communes!
Il ne faut pas regrouper les 2 électrons de valence du calcium sur un seul côté. En effet, selon les règles à suivre, il faut les placer individuellement avant de les placer par paire.

Quelle est la notation de Lewis de l’atome de soufre |(\text{S})?|
L’atome de soufre |(\text{S})| fait partie de la famille VIA. Il comprend donc 6 électrons de valence.
-
On commence par représenter le symbole chimique de cet élément, soit S.
-
On place ses 6 électrons de valence un à la fois de chaque côté du symbole de l’atome afin d’obtenir sa notation de Lewis.
On remarque qu’il y a plusieurs notations possibles pour représenter le soufre. Dans tous les cas, on voit que le soufre a 2 doublets d’électrons et 2 électrons célibataires.

Attention aux erreurs communes!
-
Il ne faut pas répartir les 6 électrons séparément autour du symbole chimique de l’atome. En effet, selon les règles à suivre, une fois qu’un électron a été distribué sur chacun des quatre côtés du symbole, les électrons suivants doivent être placés par paire, de manière à indiquer qu’ils forment un doublet.

-
Il ne faut pas regrouper 3 électrons de valence sur un seul côté. En effet, selon les règles à suivre, chaque côté a un maximum de 2 électrons.

-
Il ne faut pas grouper immédiatement les électrons par paire. Il faut les placer individuellement avant de les placer par paire.

-
Il ne faut pas placer les doublets d’électrons ainsi. En effet, les doublets doivent être alignés de façon parallèle au côté sur lequel ils se trouvent.

En plus de permettre de représenter des atomes individuels, la notation de Lewis est employée pour représenter les liaisons chimiques entre les atomes. La notation de Lewis permet donc de représenter des molécules ainsi que des composés ioniques.
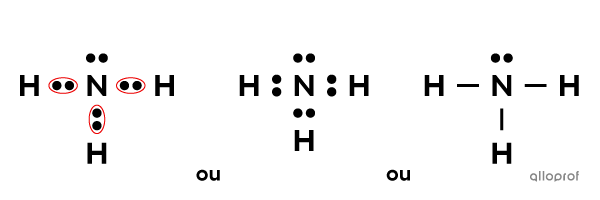
L’ammoniac |(\text{NH}_3)| est une molécule comprenant un atome d’azote |(\text{N})| lié à 3 atomes d’hydrogène |(\text{H}).| Les liaisons entre les atomes de cette molécule sont des liaisons covalentes.
La notation de Lewis de l’ammoniac est la suivante.
Le chlorure de sodium |(\text{NaCl})| est un composé ionique comprenant un ion sodium |(\text{Na}^+)| lié à un ion chlorure |(\text{Cl}^-).| L’interaction entre la charge positive du sodium et la charge négative du chlorure engendre une liaison ionique.
La notation de Lewis du chlorure de sodium est la suivante.

Pour en savoir plus sur la notation de Lewis des molécules et des composés ioniques, tu peux consulter les différentes sections de la fiche sur les liaisons ionique et covalente.