Choisis ton niveau.
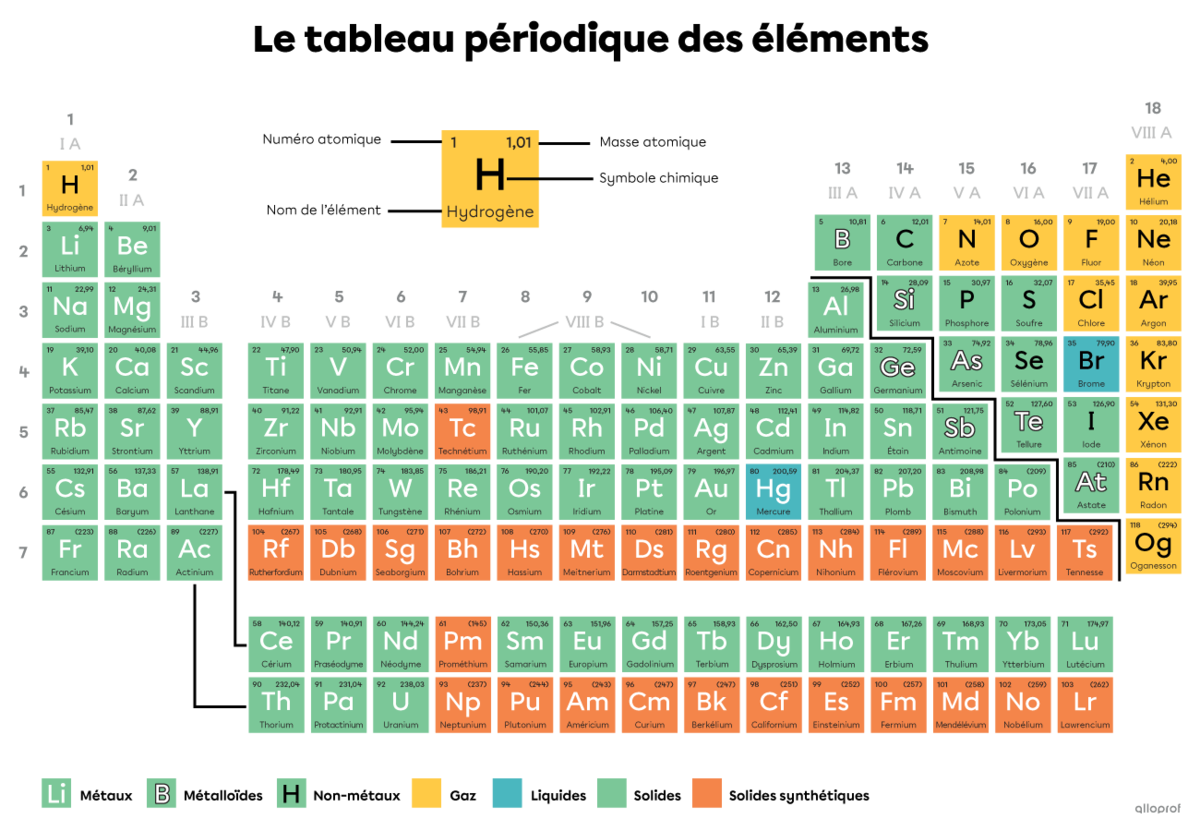
Le tableau périodique regroupe tous les éléments chimiques. Ils y sont classés en fonction de certaines caractéristiques.
Au courant des années 1800, des chimistes avaient remarqué des caractéristiques communes entre certains éléments et ont voulu les classer de façon logique. Bien que certains d’entre eux aient réfléchi à différentes classifications, c’est le chimiste russe Dmitri Mendeleïev qui présenta officiellement en 1869 la structure du tableau périodique, tel qu’on le connait aujourd’hui.
De plus, cette structure lui a permis non seulement de classer les éléments alors découverts, mais aussi de prévoir la découverte de nouveaux éléments. Au départ, il a laissé des espaces vides dans le tableau pour des éléments encore inconnus à l’époque. Avec le temps, ces espaces vides ont été comblés, confirmant ainsi ses prévisions.
Source : s.a., 1897[1].
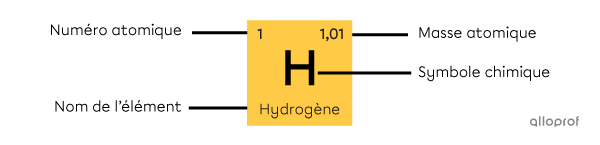
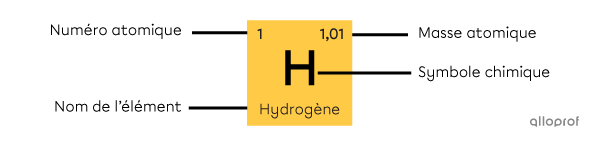
Chaque case du tableau périodique correspond à un élément chimique. Ces cases renferment plusieurs informations sur l’élément, telles que :
-
son numéro atomique;
-
son nom;
-
son symbole chimique;
-
sa masse atomique.
La couleur de la case donne aussi généralement de l’information sur l’état de l’élément.
Les informations peuvent être placées à différents endroits dans la case selon le tableau périodique. Il est important de consulter la légende du tableau pour s’y retrouver.
Chaque élément a un numéro qui lui est propre, qu’on appelle numéro atomique. Les 118 éléments du tableau périodique sont classés en ordre croissant de numéro atomique, soit de 1 à 118. Le numéro atomique a été attribué à chaque élément en fonction de la structure interne de ses atomes.

En plus d’avoir un numéro atomique, les éléments ont un nom, qui permet de les identifier dans le vocabulaire usuel. L’origine des noms varie beaucoup. Il y a des noms donnés en l’honneur de dieux grecs, de scientifiques ou d’endroits. D’autres noms sont donnés en fonction des propriétés des éléments. C’est le cas du fer, qui vient du mot latin ferrum, qui veut dire ferme, solide.

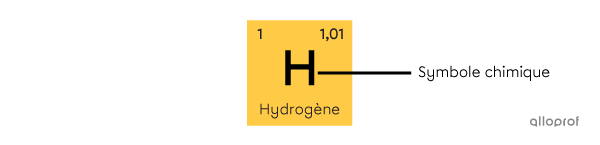
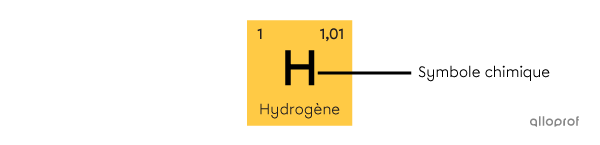
Le symbole chimique est composé d’une lettre majuscule, parfois accompagnée d’une lettre minuscule. Le symbole chimique est dérivé du nom latin de l’élément. Il est le même dans toutes les langues. Souvent, il correspond aussi aux premières lettres du nom en français, mais ce n’est pas toujours le cas. L’hydrogène (H), l’hélium (He), le lithium (Li), le carbone (C) sont tous les éléments dont le symbole correspond aux premières lettres de leur nom. Toutefois, le nom azote vient du nom latin nitrogenium. Son symbole chimique est N.
La masse atomique d’un élément est la masse d’un seul atome de cet élément. Comme la masse d’un atome est très petite, on la mesure généralement en unités atomiques (u) pour simplifier les calculs. C’est d’ailleurs cette unité qui est utilisée dans le tableau périodique. Une unité atomique correspond environ à la masse de l’hydrogène, l’élément le plus léger.

La couleur d’une case dans le tableau périodique renseigne généralement sur l’état de la substance à une température de 0 °C. Les couleurs et l’état auquel elles correspondent sont identifiés dans une légende. Dans le tableau périodique, au haut de cette page, la légende indique que les cases jaunes correspondent aux éléments à l’état gazeux, les cases bleues correspondent aux éléments à l’état liquide, les cases vertes correspondent aux éléments à l’état solide et les cases orange correspondent aux éléments qui sont des solides synthétiques. Les solides synthétiques n’existent pas dans la nature, ils sont produits en laboratoire.
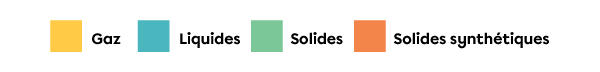
Le tableau périodique regroupe tous les éléments chimiques. Ils y sont classés en fonction de la composition de leur noyau et de leur configuration électronique.
Au courant des années 1800, des chimistes avaient remarqué des caractéristiques communes entre certains éléments et ont voulu les classer de façon logique. Bien que certains d’entre eux aient réfléchi à différentes classifications, c’est le chimiste russe Dmitri Mendeleïev qui présenta officiellement en 1869 la structure du tableau périodique, tel qu’on le connait aujourd’hui.
De plus, cette structure lui a permis non seulement de classer les éléments alors découverts, mais aussi de prévoir la découverte de nouveaux éléments. Au départ, il a laissé des espaces vides dans le tableau pour des éléments encore inconnus à l’époque. Avec le temps, ces espaces vides ont été comblés, confirmant ainsi ses prévisions.
Source : s.a., 1897[1].
Chaque case du tableau périodique correspond à un élément chimique. Ces cases renferment plusieurs informations sur l’élément, telles que :
-
son numéro atomique;
-
son nom;
-
son symbole chimique;
-
sa masse atomique.
La couleur de la case donne aussi généralement de l’information sur l’état de l’élément. Dans certains cas, la couleur du symbole chimique indique si l’élément est un métal, un métalloïde ou un non-métal.
Les informations peuvent être placées à différents endroits dans la case selon le tableau périodique. Il est important de consulter la légende du tableau pour s’y retrouver.
Chaque élément a un numéro qui lui est propre, qu’on appelle numéro atomique. Les 118 éléments du tableau périodique sont classés en ordre croissant de numéro atomique, soit de 1 à 118. Un numéro atomique a été attribué à chaque élément en fonction de la composition de son noyau. Il correspond au nombre de protons contenus dans le noyau des atomes.

En plus d’avoir un numéro atomique, les éléments ont un nom, qui permet de les identifier dans le vocabulaire usuel. L’origine des noms varie beaucoup. Il y a des noms donnés en l’honneur de dieux grecs, de scientifiques ou d’endroits. D’autres noms sont donnés en fonction des propriétés des éléments. C’est le cas du fer, qui vient du mot latin ferrum, qui veut dire ferme, solide.

Le symbole chimique est composé d’une lettre majuscule, parfois accompagnée d’une lettre minuscule. Le symbole chimique est dérivé du nom latin de l’élément. Il est le même dans toutes les langues. Souvent, il correspond aussi aux premières lettres du nom en français, mais ce n’est pas toujours le cas. L’hydrogène |(\text{H}),| l’hélium |(\text{He}),| le lithium |\text{(Li}),| le carbone |(\text{C})| sont tous les éléments dont le symbole correspond aux premières lettres de leur nom. Toutefois, le nom azote vient du nom latin nitrogenium. Son symbole chimique est |\text{N}.|
La masse atomique d’un élément est la masse d’un seul atome de cet élément. Comme la masse d’un atome est très petite, on la mesure généralement en unités atomiques |(\text{u})| pour simplifier les calculs. C’est d’ailleurs cette unité qui est utilisée dans le tableau périodique. Une unité atomique correspond environ à la masse d’un atome d’hydrogène, l’élément le plus léger.

La couleur d’une case dans le tableau périodique renseigne généralement sur l’état de la substance à une température de |0\ ^\circ\text{C}| et à une pression de |101{,}3\ \text{kPa}.| Les couleurs et l’état auquel elles correspondent sont identifiés dans une légende. Dans le tableau périodique au haut de cette page, la légende indique que les cases jaunes correspondent aux éléments à l’état gazeux, les cases bleues correspondent aux éléments à l’état liquide, les cases vertes correspondent aux éléments à l’état solide et les cases orange correspondant aux éléments qui sont des solides synthétiques. Les solides synthétiques n’existent pas dans la nature, ils sont produits en laboratoire.
La couleur du symbole chimique peut renseigner sur le groupe auquel appartient l’élément, c’est-à-dire s’il est un métal, un métalloïde ou un non-métal. Dans le tableau périodique au haut de cette page, la légende indique que les symboles chimiques blancs correspondent aux métaux, les symboles chimiques blancs avec une bordure noire correspondent aux métalloïdes et les symboles chimiques noirs correspondent aux non-métaux.

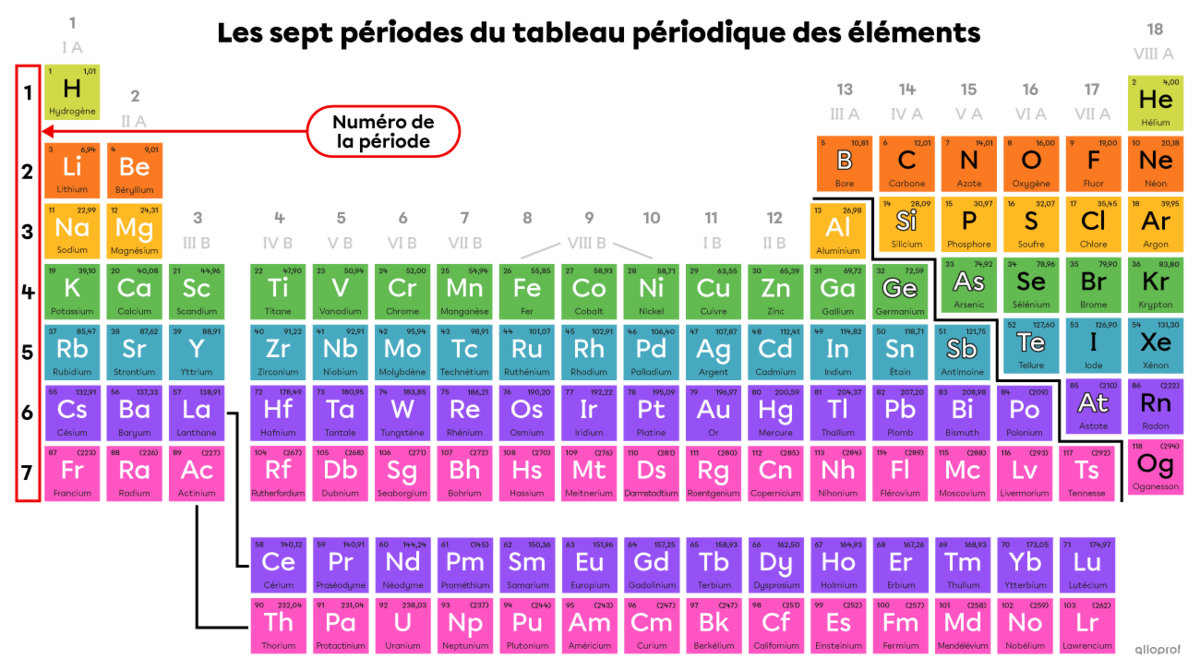
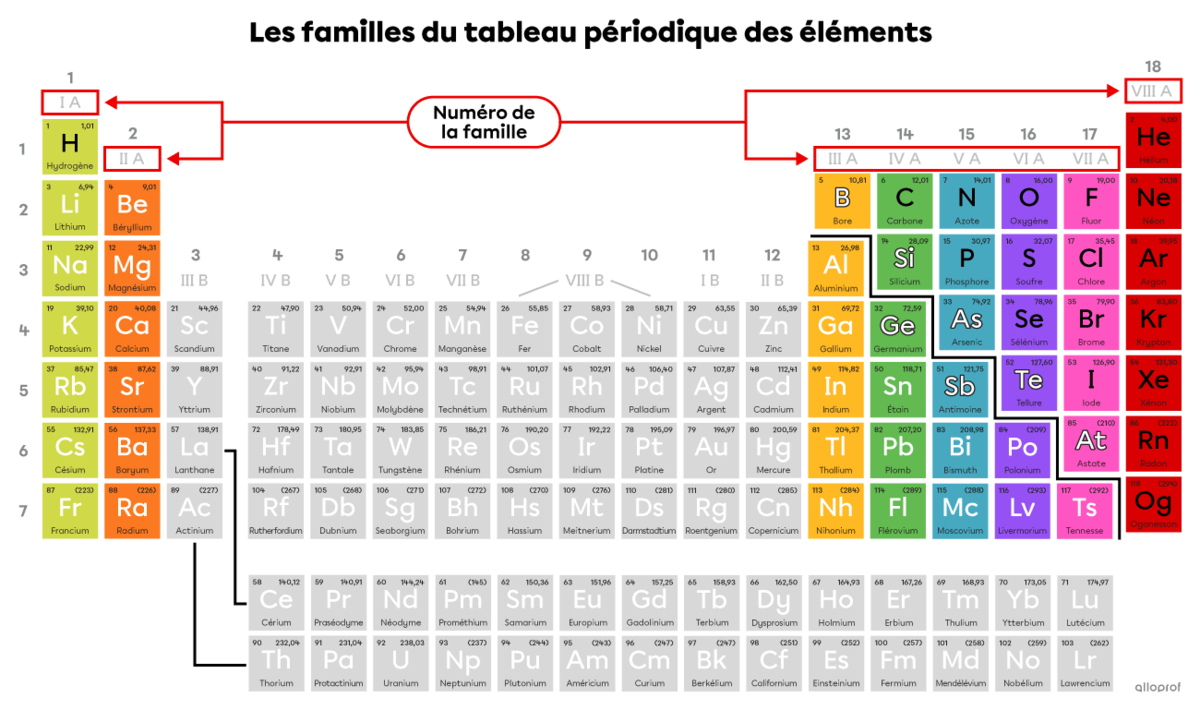
Les éléments du tableau périodique sont organisés en rangées et en colonnes. Les rangées correspondent aux périodes et les colonnes correspondent aux familles. Cette classification a été établie en fonction de la configuration électronique des éléments. Il est donc possible, selon l’emplacement d’un élément dans le tableau périodique, de déterminer le nombre d’électrons et leur disposition autour du noyau de l’atome.
Les périodes indiquent le nombre de couches électroniques d’un atome. Il y en a sept au total. Le numéro de la période correspond au nombre de couches électroniques que possède l’atome.
Les familles indiquent le nombre d’électrons sur la dernière couche électronique, soit les électrons de valence. Le numéro de la famille est identifié en chiffres romains. Les familles qui sont abordées au secondaire sont seulement celles qui portent un A dans leur numéro. Puisqu’ils ont le même nombre d’électrons de valence, les éléments d’une même famille ont la même réactivité chimique, c’est-à-dire la même tendance à réagir avec d’autres éléments.
Remarques :
-
L’hydrogène |(\text{H})| est une exception. Il ne fait pas partie de la famille IA même s’il est dans la même colonne. Il a toutefois un seul électron de valence.
-
L’hélium |(\text{He})| fait partie de la famille VIII A, mais il n’a que 2 électrons de valence.
Le numéro de la période et le numéro de la famille permettent de représenter l’atome selon les modèles suivants.
Pour valider ta compréhension à propos du tableau périodique de façon interactive, consulte la MiniRécup suivante :

-
Dmitri Ivanovitch Mendeleïev [photographie]. (1897). Wikimedia commons. https://commons.wikimedia.org/wiki/File:DIMendeleevCab.jpg