Une substance pure est une substance qui est constituée d’une seule sorte de particules.
Dans les deux exemples ci-dessous, toutes les particules de chaque substance sont identiques. Ce sont des substances pures.
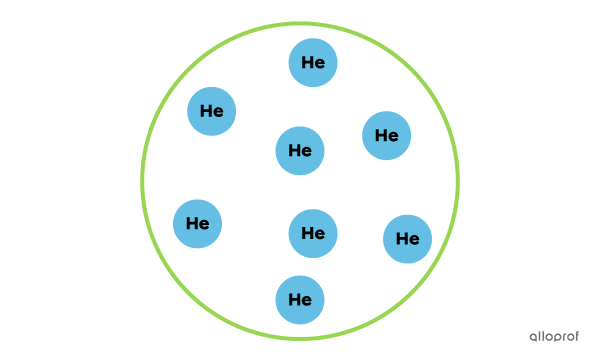
Cet échantillon est une substance pure, puisqu'il contient uniquement des atomes d'hélium.
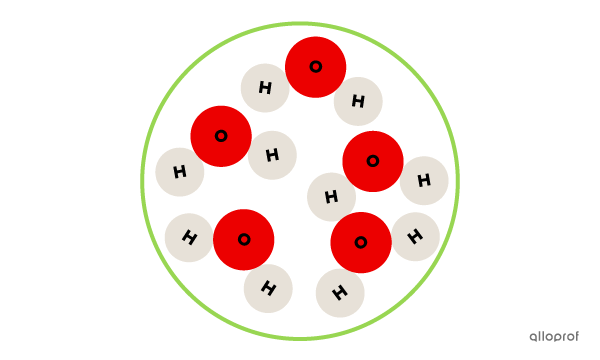
Cet échantillon est une substance pure, puisqu'il contient uniquement des molécules d'eau.
Les substances pures regroupent les éléments et les composés.
Un élément est une substance constituée d’une seule sorte d’atomes.
Un élément peut être un atome seul ou une molécule composée de plusieurs atomes identiques. Toutes les sortes d’atomes sont présentées et classées dans le tableau périodique des éléments.
L’atome d’oxygène |(\text{O}),| la molécule de dioxygène |(\text{O}_2)| et la molécule d’ozone |(\text{O}_3)| sont tous trois des éléments, parce qu’ils sont constitués d’une seule sorte d’atomes, soit de l’oxygène |(\text{O}).|



On peut reconnaitre si une substance est un élément grâce à sa formule chimique. Lorsque la formule chimique contient une seule lettre majuscule, la substance est un élément. En effet, le symbole chimique de chaque élément du tableau périodique contient toujours une seule lettre majuscule.
Une substance contient autant de sortes d’atomes que sa formule chimique contient de lettres majuscules.
-
L’atome de brome |({\color{#EC0000}{\text{B}}\text{r}})| est un élément, parce qu’il ne contient que du brome |(\text{Br}).|
-
La molécule de dichlore |({\color{#EC0000}{\text{C}}\text{l}_2})| est un élément, parce qu’elle ne contient que du chlore |(\text{Cl}).|
-
La molécule d’ozone |({\color{#EC0000}{\text{O}}_3})| est un élément, parce qu’elle ne contient que de l’oxygène |(\text{O}).|
Leur formule chimique ne contient qu’une seule lettre majuscule.
Un composé est une substance pure constituée de plusieurs sortes d’atomes.
Un composé est toujours constitué d’au moins deux atomes de sortes différentes. Toutes les sortes d’atomes sont présentées et classées dans le tableau périodique des éléments.
Le chlorure de sodium |(\text{NaCl}),| le méthane |(\text{CH}_4)| et l’acide nitrique |(\text{HNO}_3)| sont des composés, parce qu’ils sont tous constitués de plusieurs sortes d’atomes.

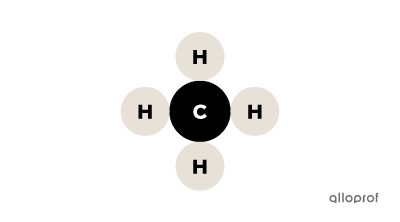
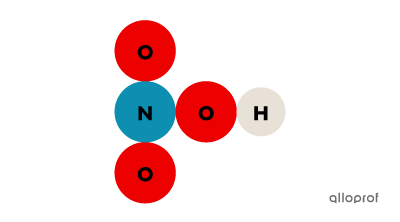
On peut reconnaitre si une substance est un composé grâce à sa formule chimique. Lorsque la formule chimique contient plus d’une lettre majuscule, la substance est un composé. En effet, le symbole chimique de chaque élément du tableau périodique contient toujours une seule majuscule. S’il y a plus d’une lettre majuscule dans la formule chimique, il y a donc nécessairement plus d’un atome dans la substance.
Une substance contient autant de sortes d’atomes que sa formule chimique contient de lettres majuscules.
-
L’acide chlorhydrique |({\color{#EC0000}{\text{HC}}\text{l}})| est un composé, parce qu’il contient deux sortes d’atomes; l’hydrogène |({\color{#EC0000}{\text{H}}})| et le chlore |({\color{#EC0000}{\text{C}}}\text{l}).|
-
Le glucose |({\color{#EC0000}{\text{C}}_6}{\color{#EC0000}{\text{H}}_{12}}{\color{#EC0000}{\text{O}}_6})| est un composé, parce qu’il contient trois sortes d’atomes; le carbone |({\color{#EC0000}{\text{C}}}),| l’hydrogène |({\color{#EC0000}{\text{H}}})| et l’oxygène |({\color{#EC0000}{\text{O}}}).|
-
L’eau |({\color{#EC0000}{\text{H}}_2}{\color{#EC0000}{\text{O}}})| est un composé, parce qu’elle contient deux sortes d’atomes; l’hydrogène |({\color{#EC0000}{\text{H}}})| et l’oxygène |({\color{#EC0000}{\text{O}}}).|
Leur formule chimique contient plus d’une lettre majuscule.
Une erreur s’est glissée dans cette vidéo.
À 1 min 49 s, la formule chimique est plutôt |\text{HCl},| et non |\text{HCl}_2|.