Choisis ton niveau.
Une molécule est un regroupement d’au moins deux atomes liés chimiquement entre eux.
En réalité, une molécule est un regroupement d’au moins deux non-métaux liés chimiquement entre eux. Lorsque des atomes représentés dans l’image suivante sont liés entre eux, ils forment une molécule. Les métaux, quant à eux, ne forment pas de molécule, mais un autre type de substance. C’est ce qui est enseigné en 4e secondaire, lorsqu’on fait la distinction entre les métaux et les non-métaux.
Remarque : Le cas des métalloïdes n’est pas abordé au secondaire.
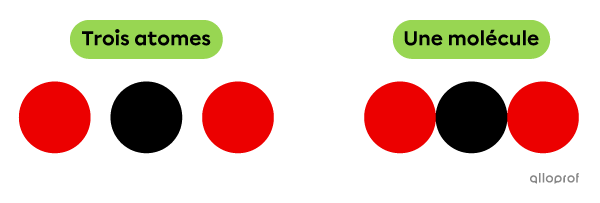
Selon le modèle atomique de Dalton, les atomes sont représentés par des boules de couleur. Ainsi, une molécule est représentée par une combinaison d’au moins deux boules.
La molécule représentée dans l’image suivante est une combinaison de trois atomes liés chimiquement.
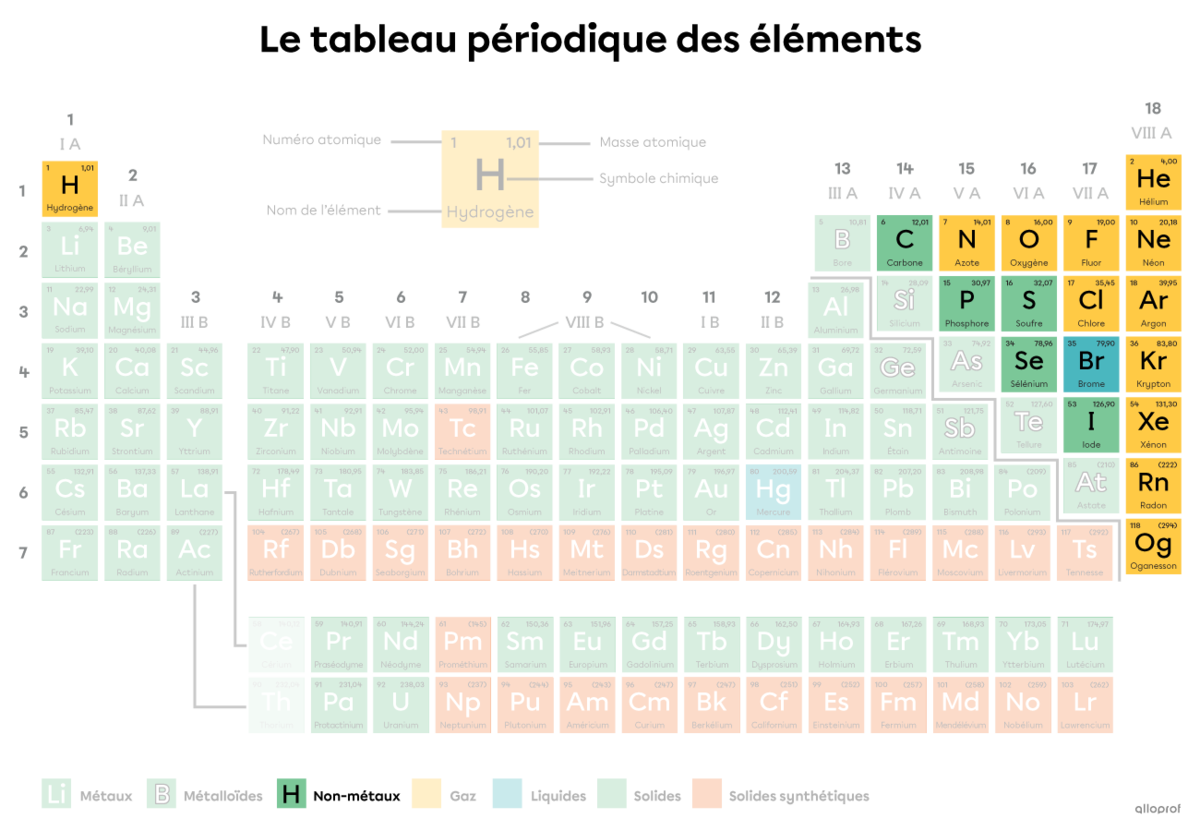
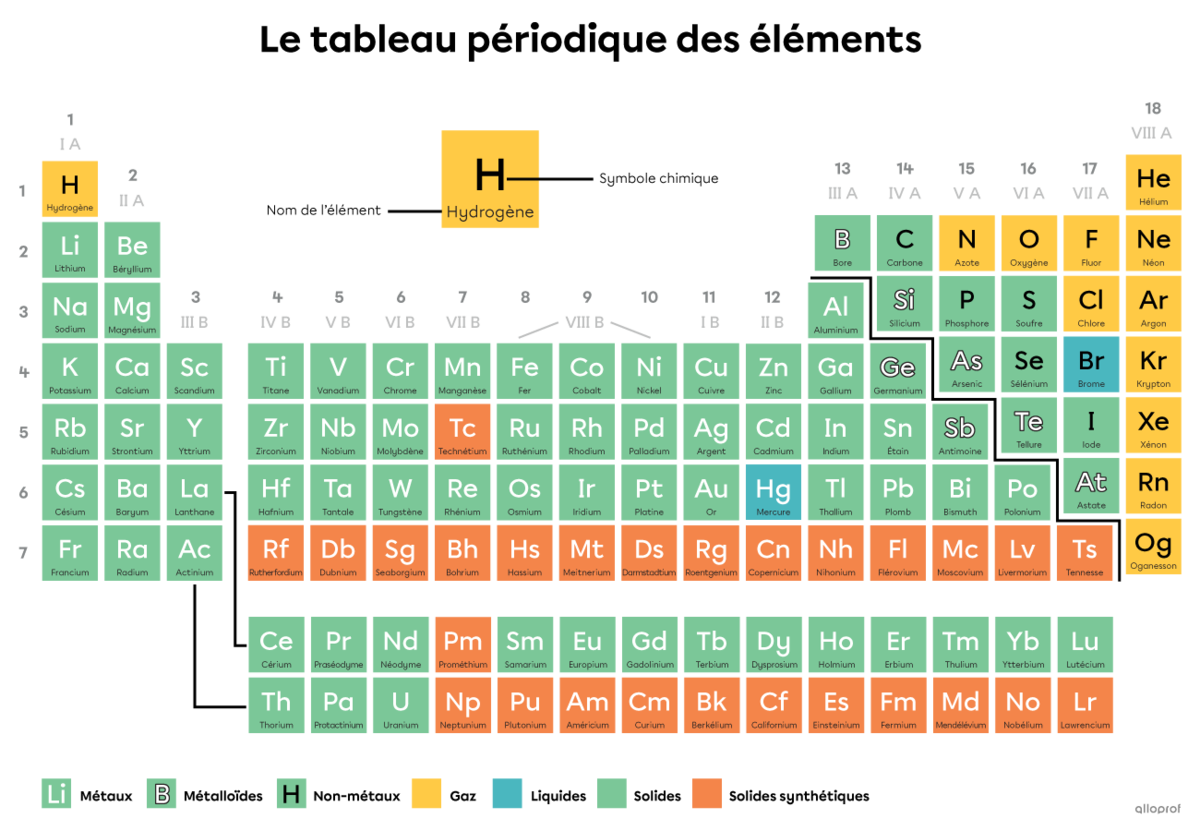
Dans le tableau périodique des éléments, on retrouve tous les éléments, c’est-à-dire toutes les sortes d’atomes. Une molécule est une combinaison d’au moins deux atomes figurant dans le tableau périodique. Ces atomes peuvent être de même sorte ou de sortes différentes.
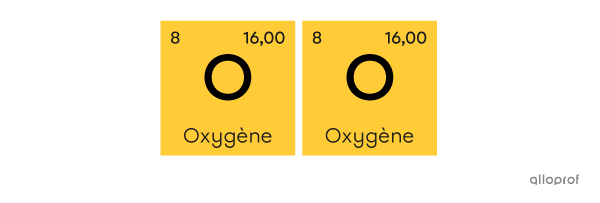
La molécule de dioxygène |\text{(O}_2)| est faite de deux atomes d’oxygène |(\text{O}).|

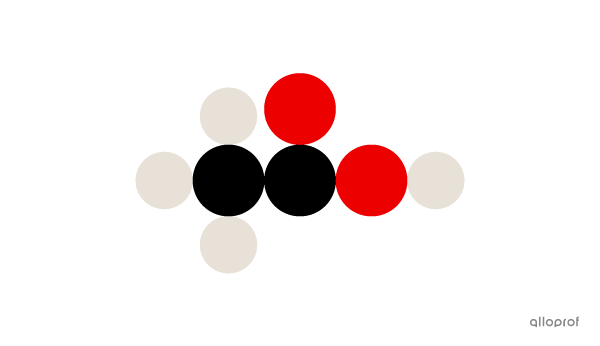
La molécule d’acide acétique |(\text{CH}_3\text{COOH})| est faite de quatre atomes d’hydrogène |(\text{H}),| de deux atomes de carbone |(\text{C})| et de deux atomes d’oxygène |(\text{O}).|
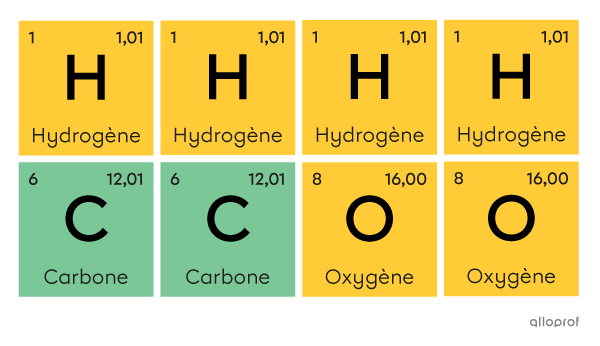
Pour reconnaitre une molécule à partir de sa formule chimique, on peut vérifier si on y retrouve plus d’une lettre majuscule et/ou un chiffre en indice.
Toutes les sortes d’atomes (éléments) ont un symbole qui ne contient qu’une seule lettre majuscule. Ainsi, lorsque la formule chimique contient plusieurs lettres majuscules, il y a nécessairement présence de plusieurs atomes. Par exemple, |\text{HCl}| contient deux lettres majuscules. Cette substance contient donc deux sortes d’atomes : l’hydrogène |(\text{H})| et le chlore |(\text{Cl}).| C’est une molécule.
L’indice dans une formule chimique indique le nombre d’atomes d’une même sorte qu’on y retrouve. On écrit un indice dans la formule chimique seulement lorsqu’on y retrouve plus d’un atome d’une même sorte. Nécessairement, s’il y a un indice, il y a plus d’un atome. Par exemple, |\text{I}_2| contient un 2 en indice. Cette substance contient donc deux atomes d’iode |(\text{I}).| C’est une molécule.
Une molécule n’a pas les mêmes propriétés que les éléments dont elle est faite.
Lorsque des atomes liés entre eux se séparent et se lient de façon différente, ils forment de nouvelles molécules. Ces nouvelles molécules n’ont pas les mêmes propriétés que les molécules initiales, même si elles sont faites des mêmes atomes. En effet, une réaction chimique s’est produite.
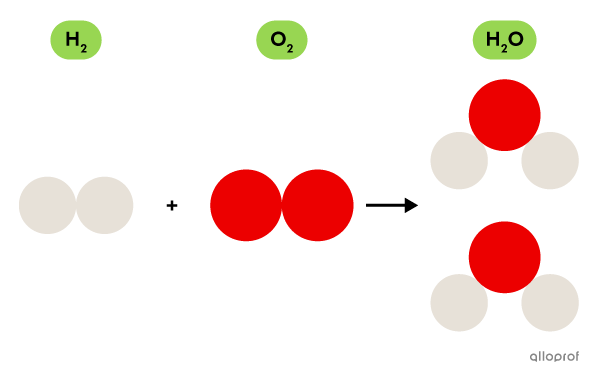
Une molécule d’eau est formée à partir d’oxygène |(\text{O})| et d’hydrogène |(\text{H}).|
Le dioxygène |(\text{O}_2)|, fait d’atomes d’oxygène |(\text{O}),| est un gaz essentiel à la respiration alors que le dihydrogène |(\text{H}_2)|, fait d’atomes d’hydrogène |(\text{H}),| est un gaz inflammable.
La molécule d’eau |(\text{H}_2\text{O}),| quant à elle, n’est pas essentielle à la respiration et n’est pas inflammable. Elle a plutôt la propriété de dissoudre plusieurs substances, comme le sel, le sucre ou le gaz carbonique, par exemple.
Même si la molécule |\text{H}_2\text{O}| est formée des atomes qu’on retrouve dans la molécule |\text{O}_2| et dans la molécule |\text{H}_2,| les propriétés de ces trois molécules sont très différentes.
Pour valider ta compréhension à propos de l’organisation de la matière de façon interactive, consulte la MiniRécup suivante.

Une molécule est un regroupement d’au moins deux non-métaux liés chimiquement entre eux.
Les regroupements de métaux avec des non-métaux ne sont pas des molécules, mais plutôt des sels, aussi appelés composés ioniques.
Les métalloïdes sont des éléments qui ont des propriétés qui peuvent varier selon le contexte. Ainsi, les métalloïdes peuvent former aussi bien des molécules que des sels (composés ioniques).
Par exemple, le borane |(\text{BH}_3)| est une molécule, tandis que le trifluorure de bore |(\text{BF}_3)| est un composé ionique.
Pour identifier une molécule, on peut recourir à sa formule chimique ou à son nom.
La formule chimique d’une molécule s’appelle plus précisément la formule moléculaire. Elle contient le symbole chimique de tous les atomes qui composent la molécule. Ces symboles chimiques sont accompagnés d’un indice lorsque l’atome est présent en double ou plus.
Pour nommer une molécule, on doit respecter les règles de nomenclature chimique.
Pour désigner la molécule suivante, on peut l’appeler par son nom, le méthane, ou utiliser sa formule chimique, |\text{CH}_4.|
-
Le symbole |\text{C}| indique la présence de carbone dans la molécule.
-
L’absence d’indice pour le symbole |\text{C}| signifie qu’il y a 1 seul atome de carbone dans la molécule.
-
Le symbole |\text{H}| indique la présence d’hydrogène dans la molécule.
-
L’indice 4 qui suit le |\text{H}| signifie qu’il y a 4 atomes d’hydrogène dans la molécule.

Une molécule peut être représentée selon le modèle atomique de Dalton.
Voici une molécule d’acide acétique |(\text{CH}_3\text{COOH})| selon le modèle atomique de Dalton.
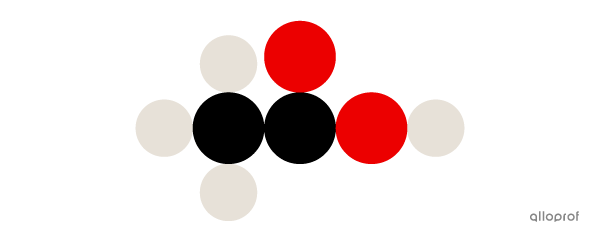
On peut aussi représenter la molécule selon la notation de Lewis et le modèle atomique de Rutherford. Ce sont deux représentations abordées dans le cours Science et technologie de l’environnement (STE).
Voici une molécule de diazote |(\text{N}_2)| selon la notation de Lewis.
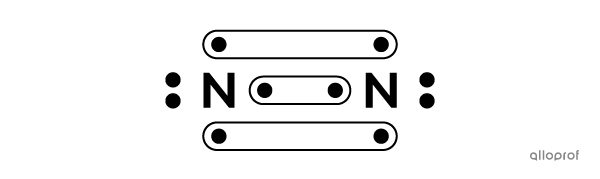
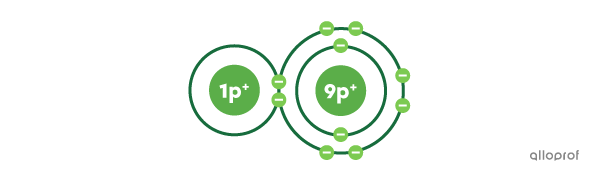
Voici une molécule d’acide fluorhydrique |(\text{HF})| selon le modèle atomique de Rutherford-Bohr.