Lorsque deux atomes interagissent, ils peuvent former une liaison chimique. Généralement, cette liaison chimique est covalente ou ionique.
|
Liaison covalente |
Liaison ionique |
|
|---|---|---|
|
Éléments liés |
Non-métal lié à un non-métal |
Non-métal lié à un métal |
|
Type d’interaction entre les éléments liés |
Partage d’électrons |
Transfert d’électron(s) |
|
Différence d’électronégativité entre les atomes liés |
Faible à moyenne |
Grande |
|
Ions formés? |
Pas d’ion formé |
Ions formés |
|
Type de substance formée |
|
|
Remarque : Les métalloïdes sont des éléments qui ont la capacité de faire des liaisons covalentes ou des liaisons ioniques, selon le contexte. Ils ne sont donc pas inclus dans ce tableau.
Une liaison chimique entre deux atomes correspond à un partage ou un transfert d’électron(s) entre ces deux atomes.
Une liaison permet généralement aux deux atomes impliqués d’être plus stables en obtenant la même configuration électronique qu’un gaz inerte. Un gaz inerte est très stable, puisque sa dernière couche électronique contient le nombre maximal d’électrons permis. Sa dernière couche électronique est dite saturée.
Lorsqu’un atome a la même configuration électronique qu’un gaz inerte, on dit qu’il respecte la règle du duet ou de l’octet. Cela lui donne une grande stabilité.
Lorsque les deux atomes de fluor |(\text{F})| ne sont pas liés, ils ont chacun 7 électrons sur la couche électronique la plus éloignée du noyau. Ils n’ont donc pas la configuration électronique d’un gaz rare.
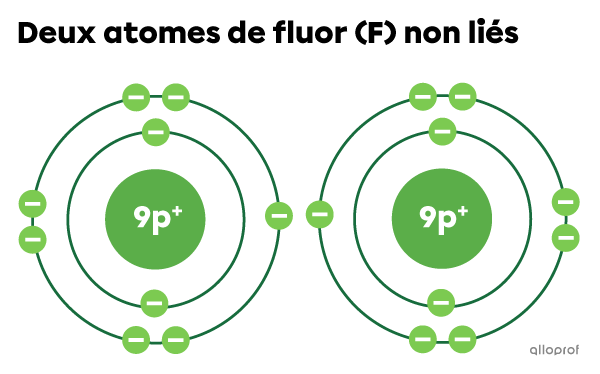
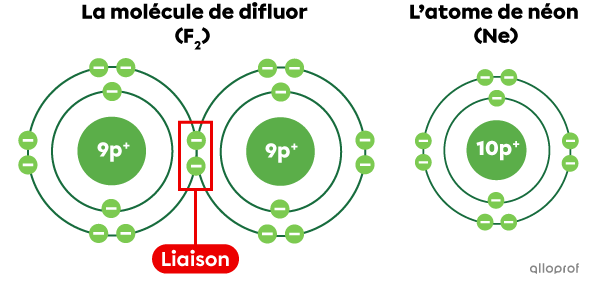
Lorsque les deux atomes de fluor |(\text{F})| sont liés, ils forment la molécule |\text{F}_2.| En partageant des électrons, les atomes de fluor ont chacun 8 électrons sur leur dernière couche électronique, ce qui correspond à la configuration électronique du néon |(\text{Ne}).| Cela rend les deux atomes de fluor |(\text{F})| plus stables.
Il existe plusieurs types de liaisons chimiques. Les liaisons les plus communes sont les liaisons covalentes et les liaisons ioniques.
Une liaison covalente correspond au partage d’une paire d’électrons entre deux atomes. Ces deux atomes sont généralement des non-métaux.
Afin d’identifier les non-métaux, on se réfère au tableau périodique.
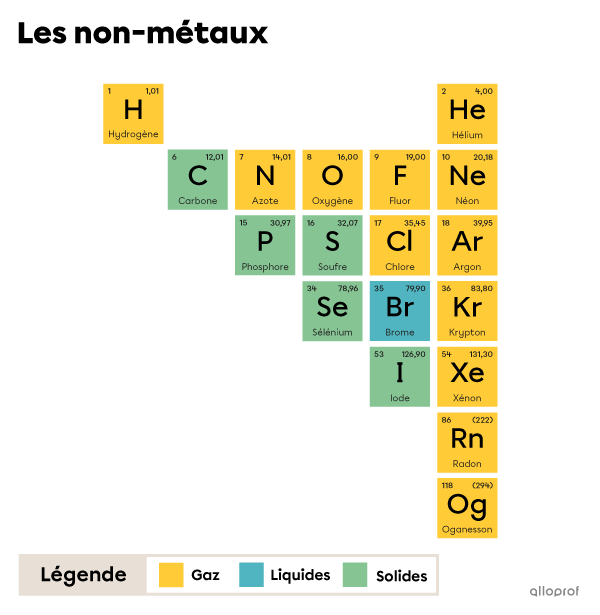
Les métalloïdes sont des éléments qui ont à la fois des propriétés similaires aux métaux et aux non-métaux. C’est ce qui fait qu’un métalloïde a la capacité de faire des liaisons covalentes ou des liaisons ioniques.
Le bore |(\text{B})| est un métalloïde.
Dans le cas du borane |(\text{BH}_3),| l’atome de bore |(\text{B})| présente des similarités avec les non-métaux. Ainsi, les atomes B et H effectuent une liaison covalente.
Dans le cas du trifluorure de bore |(\text{BF}_3),| l’atome de bore |(\text{B})| présente des similarités avec les métaux. Les atomes |(\text{B})| et |(\text{F})| effectuent alors une liaison ionique.
Chaque atome a une électronégativité qui lui est propre.
L’électronégativité est la force avec laquelle le noyau d’un atome attire les électrons impliqués dans une liaison chimique.
La différence d’électronégativité entre deux non-métaux impliqués dans une liaison covalente est généralement faible à moyenne. Ceci fait que le partage d’électrons entre les deux non-métaux est relativement équilibré.
Un assemblage d’atomes ne comprenant que des liaisons covalentes est une molécule. Si cette molécule comprend des atomes différents, on peut aussi dire qu’il s’agit d’un composé covalent, aussi appelé composé moléculaire.
Il existe plusieurs manières de représenter une liaison covalente. Par exemple, on peut employer le modèle atomique de Rutherford-Bohr ou, bien souvent, la notation de Lewis.
Voici une représentation de la formation de la molécule d’acide fluorhydrique |(\text{HF})| selon le modèle atomique de Rutherford-Bohr, ainsi que selon la notation de Lewis. Dans ce composé, la liaison entre l’atome d’hydrogène |(\text{H})| et l’atome de fluor |(\text{F})| est covalente.
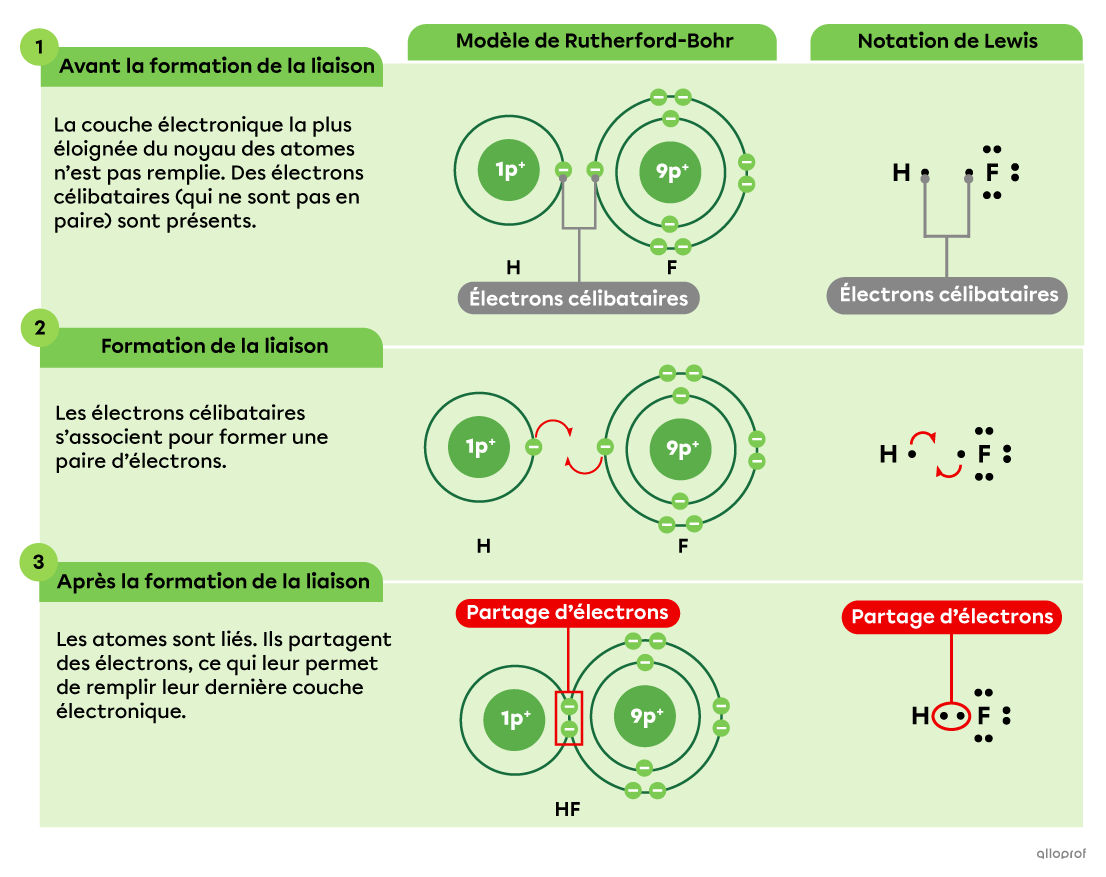
Alors que le modèle atomique de Rutherford-Bohr présente tous les électrons présents dans la molécule, la notation de Lewis permet de représenter seulement les électrons de la couche électronique la plus éloignée du noyau, soit les électrons de valence.
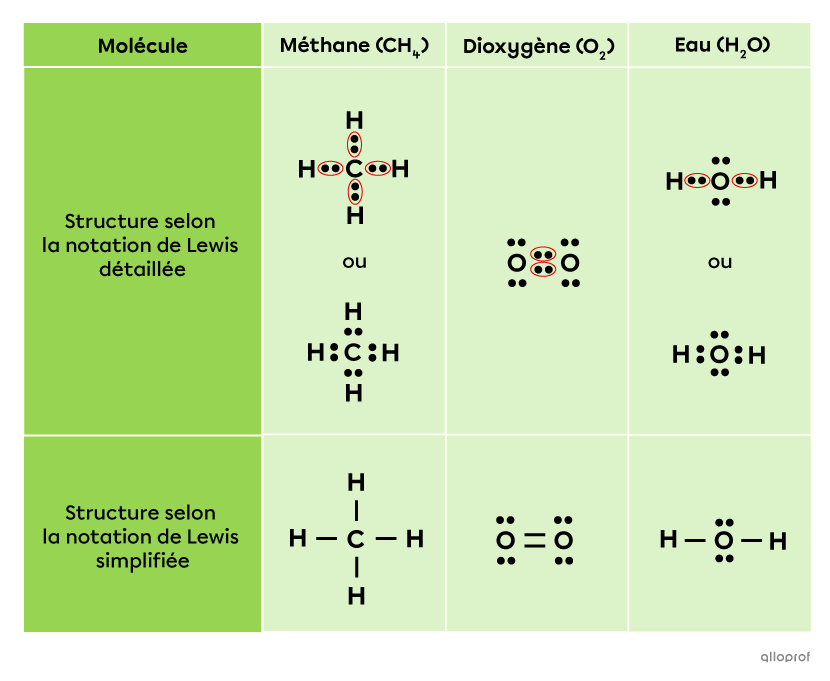
De plus, lorsqu’une liaison covalente entre deux atomes est effectuée, les deux représentations montrent que 2 électrons sont partagés entre les atomes. Cette paire d’électrons est un doublet liant et constitue la liaison covalente.
Lorsqu’on représente la liaison à l’aide de la notation de Lewis détaillée, le doublet liant est mis en évidence en encerclant les deux électrons partagés. Ce schéma peut également être simplifié en remplaçant les points encerclés par un trait.
Le tableau suivant présente la structure de diverses molécules à l’aide de la notation de Lewis détaillée et de la notation de Lewis simplifiée.
Deux atomes peuvent se lier en effectuant une liaison simple, une liaison double, une liaison triple ou, plus rarement, une liaison quadruple.
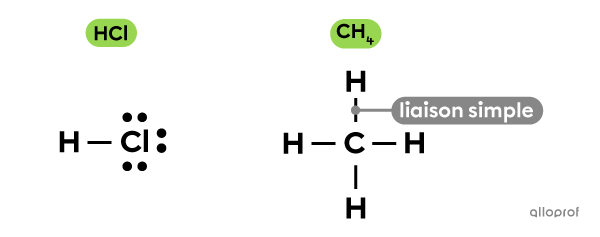
Lorsque deux atomes partagent 1 doublet d’électrons (soit 2 électrons), une liaison simple est formée. C’est ce qu’on observe entre les atomes de la molécule de méthane |(\text{CH}_4)| ou de la molécule d’acide chlorhydrique |(\text{HCl}).|
Pour représenter une liaison simple, on utilise 1 trait.
Lorsque deux atomes partagent 2 doublets d’électrons (soit 4 électrons au total), une liaison double est formée. C’est ce qu’on observe entre les atomes de la molécule de dioxygène |(\text{O}_2)| ou de la molécule de dioxyde de carbone |(\text{CO}_2).|
Pour représenter une liaison double, on utilise 2 traits.

Lorsque deux atomes partagent 3 doublets d’électrons (soit 6 électrons au total), une liaison triple est formée. C’est le cas pour la molécule de diazote |(\text{N}_2).| On observe aussi cela entre les atomes de carbone |(\text{C})| et d’azote |(\text{N})| dans la molécule d’acide cyanhydrique |(\text{HCN}).|
Pour représenter une liaison triple, on utilise 3 traits.

Plus rarement, il peut arriver que deux atomes partagent 4 doublets d’électrons (soit 8 électrons au total) afin de former une liaison quadruple. On peut observer ce type de phénomène avec certains métaux de transition (métaux des familles 3 à 12) comme le ruthénium |(\text{Ru}).|
La liaison ionique est un transfert d’électron(s) qui s’effectue généralement entre un métal et un non-métal.
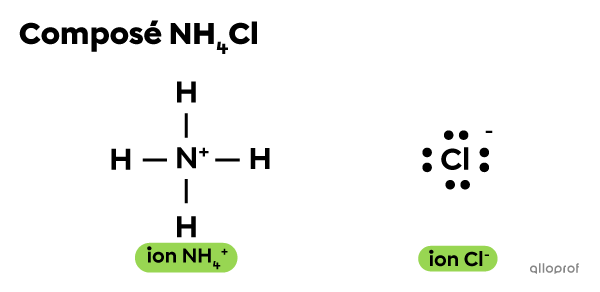
Il peut arriver qu’une liaison ionique se forme plutôt lorsqu’un ion polyatomique tel que l’ammonium |({\text{NH}_{4}}^+)| interagit avec un autre ion.
Par exemple, le chlorure d’ammonium |(\text{NH}_4\text{Cl})| est un composé qui comprend un ion ammonium |({\text{NH}_{4}}^+)| et un ion chlorure |(\text{Cl}^{-}).| Aucun de ces deux ions ne comprend d’atome métallique. Pourtant l’ion |{\text{NH}_{4}}^+| et l’ion |\text{Cl}^-| effectuent une liaison ionique.
De plus, dans certains contextes, les métalloïdes peuvent aussi former des liaisons ioniques. Puisque le cas des métalloïdes est plus complexe, il ne sera pas abordé dans cette fiche.
Afin de distinguer les métaux des non-métaux, on se réfère au tableau périodique.
Chaque atome a une électronégativité qui lui est propre. La différence d’électronégativité entre le métal et le non-métal impliqués dans une liaison ionique est généralement élevée. Cela signifie que les électrons qui participent à la liaison ne sont pas répartis uniformément entre les deux atomes : les électrons sont très attirés par l’atome le plus électronégatif.
En effet, le non-métal « arrache » un ou plusieurs électrons au métal. Ainsi, le non-métal se retrouve en surplus d’électrons et devient alors négatif. Un ion négatif est qualifié d’anion.
Le métal, qui a alors perdu un ou plusieurs électrons, devient positif. Un ion positif est qualifié de cation.
Le tableau suivant résume le comportement des atomes impliqués dans une liaison ionique.
|
Métal |
Non-métal |
|
|---|---|---|
|
Électronégativité |
Plus faible |
Plus forte |
|
Tendance |
Perte d’électron(s) |
Gain d’électron(s) |
|
Ion formé |
Cation (ion positif) |
Anion (ion négatif) |
Ainsi, un composé comprenant une liaison ionique est formé d’ions. Lorsqu’un tel composé est mis en solution aqueuse, les ions libérés permettent le passage du courant électrique. Les composés ioniques sont donc des substances électrolytiques.
Un composé comprenant une ou plusieurs liaisons ioniques n’est pas une molécule, mais un sel. Le terme sel est synonyme de composé ionique.
Il peut arriver qu’un composé comprenne à la fois des liaisons ioniques et des liaisons covalentes. Puisqu’un tel composé comprend au moins une liaison ionique, on le qualifie tout de même de composé ionique.
Il existe plusieurs manières de représenter une liaison ionique. Par exemple, on peut employer le modèle atomique de Rutherford-Bohr ou, bien souvent, la notation de Lewis.
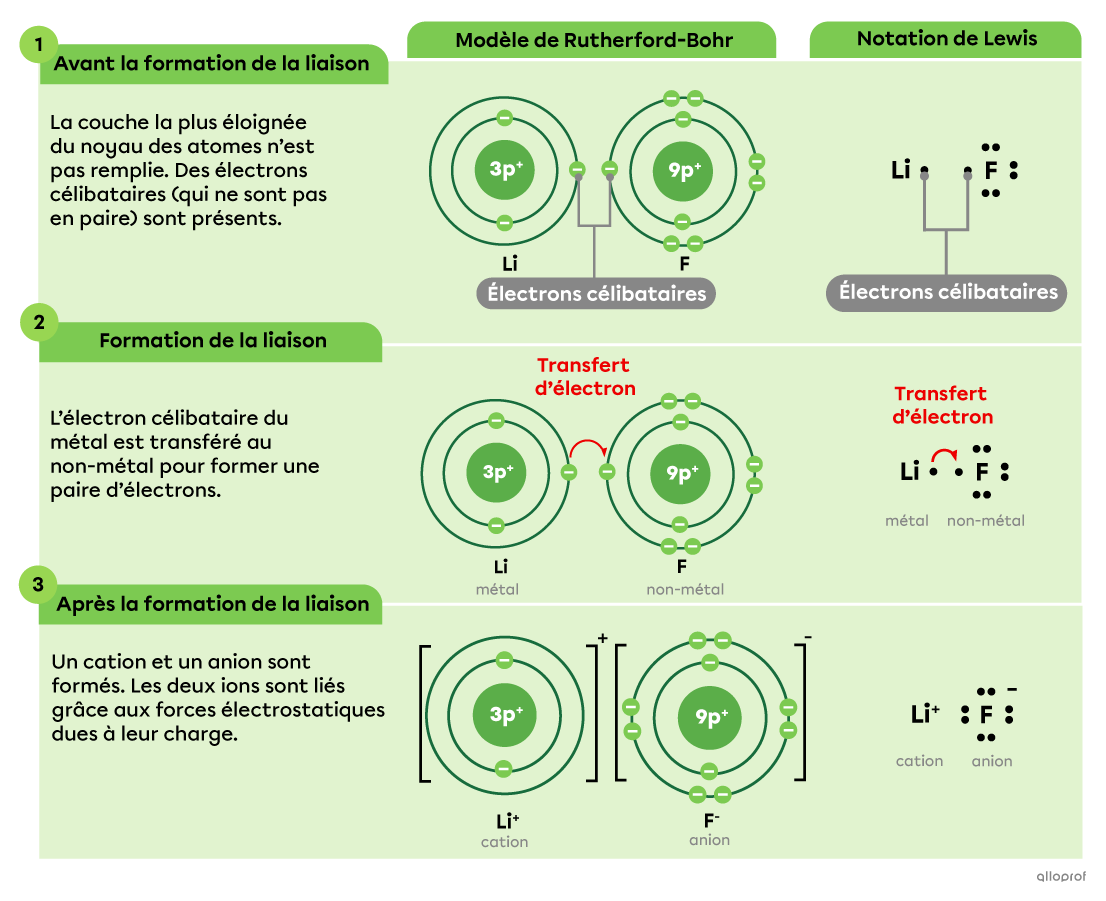
Voici une représentation de la formation du fluorure de lithium |(\text{LiF})| selon le modèle de Rutherford-Bohr, ainsi que selon la notation de Lewis. Dans ce composé, la liaison entre l’atome de lithium |(\text{Li})| et l’atome de fluor |(\text{F})| est ionique.
Quel que soit le modèle employé, on peut constater les faits suivants.
-
Un électron est transféré du lithium |(\text{Li})| au fluor |(\text{F}).| En effet, le lithium, peu électronégatif, se fait « arracher » un électron de valence par le fluor, très électronégatif.
-
En perdant un électron, l’atome de lithium forme le cation |(\text{Li}^+)| et acquiert la configuration électronique de l’hélium |(\text{He}),| un gaz inerte.
-
En gagnant un électron, l’atome de fluor forme l’anion |(\text{F}^-)| et acquiert la configuration électronique du néon |(\text{Ne}),| un gaz inerte.
Les exemples suivants présentent la formation de divers composés ioniques à l’aide de la notation de Lewis.
-
Afin de former le chlorure de sodium |(\text{NaCl})| à partir d’un atome de sodium |(\text{Na})| et d’un atome de chlore |(\text{Cl}),| un transfert d’électron est effectué.
Le sodium |(\text{Na}),| qui est un métal, est un donneur d’électron. Le chlore |(\text{Cl}),| qui est un non-métal, est un accepteur d’électron.
L’ion sodium |(\text{Na}^+)| formé se lie à l’ion chlorure |(\text{Cl}^-)| grâce à une force d’attraction électrostatique. Ainsi, ces ions forment un composé ionique.
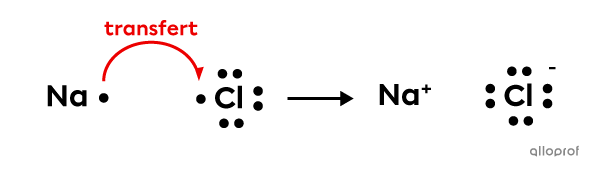
-
Afin de former l’oxyde de dipotassium |(\text{K}_2 \text{O})| à partir de deux atomes de potassium |(\text{K})| et d’un atome d’oxygène |(\text{O}),| 2 transferts d’électrons sont effectués.
Le potassium |(\text{K}),| qui est un métal, est un donneur d’électron. L’oxygène |(\text{O}),| qui est un non-métal, est un accepteur d’électrons.
Puisque chaque potassium a transféré un seul électron à l’oxygène, chaque ion potassium |(\text{K}^+)| formé a une charge positive. L’oxygène, ayant reçu 2 électrons au total, se trouve maintenant sous la forme d’un ion oxyde doublement négatif |(\text{O}^{2-}).|
Le composé obtenu |(\text{K}_2 \text{O})| présente alors 2 liaisons ioniques.

-
Afin de former le difluorure de calcium |(\text{CaF}_2)| à partir d’un atome de calcium |(\text{Ca})| et de deux atomes de fluor |(\text{F}),| 2 transferts d’électrons sont effectués.
Le calcium |(\text{Ca}),| qui est un métal, est un donneur d’électron. Le fluor |(\text{F}),| qui est un non-métal, est un accepteur d’électrons.
Puisque le calcium a donné 2 électrons au total, il se trouve maintenant sous la forme d’un ion calcium doublement positif |(\text{Ca}^{2+}).| Chaque atome de fluor a accepté un seul électron de la part du calcium, formant ainsi deux ions négatifs fluorure |(\text{F}^-).|
Le composé obtenu |(\text{CaF}_2)| présente alors 2 liaisons ioniques.
