Les gaz inertes sont des éléments très stables, car la dernière couche électronique de leurs atomes contient le nombre maximum d’électrons. Ces atomes n’ont pas tendance à perdre ou gagner des électrons ni à se lier avec d’autres atomes.
Les atomes des autres éléments ont leur dernière couche électronique incomplète. Ils sont moins stables que les gaz inertes. Afin de devenir plus stable, un atome peut perdre ou gagner des électrons et prendre la configuration électronique d’un gaz inerte. Il devient ainsi un ion et ce processus se nomme l’ionisation.
Un ion est un atome chargé électriquement après avoir subi une perte ou un gain d’électrons.
Pour connaitre la charge d’un ion, on calcule le bilan des charges. Il suffit d’additionner le nombre de charges positives (protons) et le nombre de charges négatives (électrons).
-
Si on obtient |0| (charge nulle), l’atome est neutre et ce n’est pas un ion.
-
Si on obtient une charge positive |(+),| il s’agit d’un ion, plus précisément d’un cation.
-
Si on obtient une charge négative |(-),| il s’agit d’un ion, plus précisément d’un anion.
La charge d’un ion est à droite de sa formule chimique et en exposant. Lorsque la charge est de |+1| ou de |-1,| il n’est pas nécessaire d’écrire le |1.| On écrit seulement le signe |+| ou le signe |-| en exposant.
-
Un cation est un ion chargé positivement.
-
Un anion est un ion chargé négativement.

Le bilan est de |0,| il s’agit d’un atome d’hélium |(\text{He}).|

Le résultat du bilan des charges est |+1.| L’ion de sodium est un cation et sa formule chimique est |\text{Na}^{+}.|

Le résultat du bilan des charges est |-2.| L’ion de soufre est un anion et sa formule chimique est |\text{S}^{2-}.|
-
La règle du duet est la tendance de certains atomes à prendre la configuration électronique de l’hélium |(\text{He}),| un gaz inerte qui a deux électrons de valence.
-
La règle de l’octet est la tendance de certains atomes à prendre la configuration électronique d’un gaz inerte qui a huit électrons de valence.
L’ion de lithium |(\text{Li}^{+})| respecte la règle du duet. En perdant un électron, il obtient la configuration électronique d’un atome d’hélium |(\text{He}).|

L’ion de fluor |(\text{F}^{-})| respecte la règle de l’octet. En gagnant un électron, il obtient la configuration électronique d’un atome de néon |(\text{Ne}).|
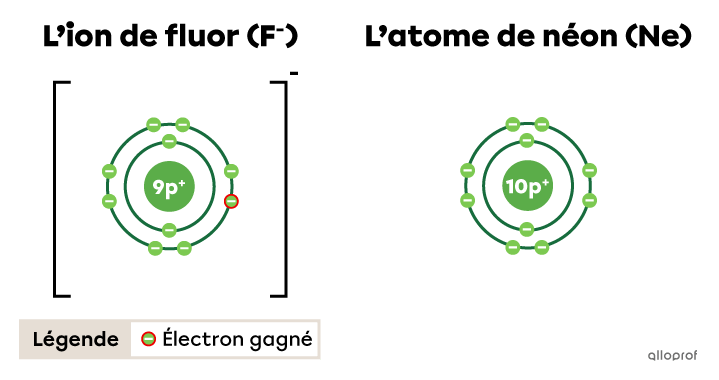
Les règles du duet et de l’octet permettent de prédire les liaisons chimiques (STE) possibles entre différents atomes. Elles aident aussi à prédire la configuration électronique et la charge obtenue par un ion.
Généralement, un atome devient un ion en prenant la configuration électronique du gaz inerte le plus près de lui dans le tableau périodique des éléments.
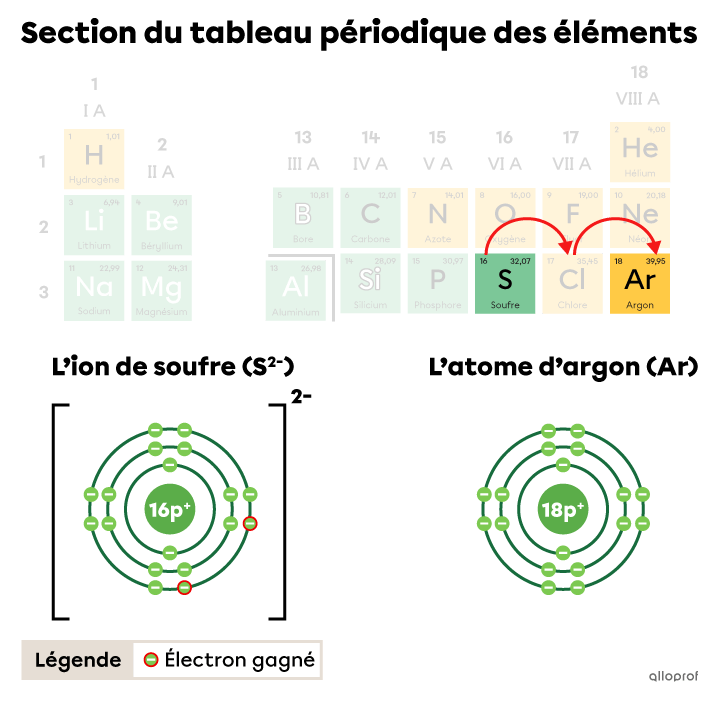
Dans le tableau périodique, on fait deux bonds vers la droite pour passer de la case du soufre |(\text{S})| à la case de l’argon |(\text{Ar}),| le gaz inerte le plus près. Ces deux bonds représentent un gain de |2| électrons pour le soufre.
L’ion de soufre |(\text{S}^{2-})| a gagné |2| électrons pour obtenir la configuration électronique d’un atome d’argon.
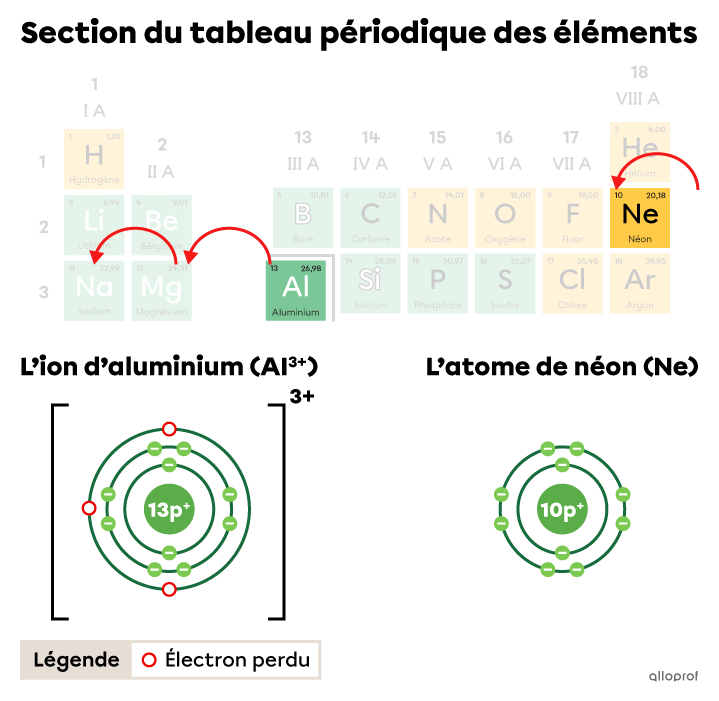
Dans le tableau périodique, on fait trois bonds vers la gauche pour passer de la case de l’aluminium |(\text{Al})| à la case du néon |(\text{Ne}),| le gaz inerte le plus près. Ces trois bonds représentent une perte de |3| électrons pour l’aluminium.
L’ion d’aluminium |(\text{Al}^{3+})| a perdu |3| électrons pour obtenir la configuration électronique d’un atome de néon.

-
L’hydrogène ne fait partie d’aucune famille. Il peut perdre un électron et obtenir une charge de |+1| ou il peut gagner un électron et obtenir une charge de| -1.|
-
Les alcalins, soit les éléments de la famille 1 (I A), ont tendance à perdre un électron et à obtenir une charge de |+1.|
-
Les alcalinoterreux, soit les éléments de la famille 2 (II A), ont tendance à perdre deux électrons et à obtenir une charge de |+2.|
-
Les éléments de la famille 13 (III A) ont tendance à perdre trois électrons et à obtenir une charge de |+3.|
-
Les éléments de la famille 14 (IV A) peuvent perdre quatre électrons et obtenir une charge de |+4| ou ils peuvent gagner quatre électrons et obtenir une charge de |-4.|
-
Les éléments de la famille 15 (V A) ont tendance à gagner trois électrons et à obtenir une charge de |-3.|
-
Les éléments de la famille 16 (VI A) ont tendance à gagner deux électrons et à obtenir une charge de |-2.|
-
Les halogènes, soit les éléments de la famille 17 (VII A), ont tendance à gagner un électron et à obtenir une charge de |-1.|
Rappel : Les gaz inertes, soit les éléments de la famille 18 (VIIIA), n’ont pas tendance à perdre ou gagner des électrons. Ils ne forment pas d’ions.
Un ion polyatomique est un ion formé d’un groupe d’atomes liés entre eux.
Voici la formule chimique de quelques ions polyatomiques et leur nom.
|
Formule chimique |
|\text{CH}_{3}\text{COO}^{-}| |
|\text{NH}_{4}{^{+}}| |
|\text{HCO}_{3}{^{-}}| |
|\text{CO}_{3}{^{2-}}| |
|\text{ClO}_{3}{^{-}}| |
|\text{CrO}_{4}{^{2-}}| |
|\text{H}_{3}\text{O}^{+}| |
|\text{OH}^{-}| |
|\text{NO}_{3}{^{-}}| |
|\text{NO}_{2}{^{-}}| |
|\text{PO}_{4}{^{3-}}| |
|\text{SO}_{4}{^{2-}}| |
|\text{SO}_{3}{^{2-}}| |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Nom |
Acétate |
Ammonium |
Bicarbonate |
Carbonate |
Chlorate |
Chromate |
Hydronium |
Hydroxyde |
Nitrate |
Nitrite |
Phosphate |
Sulfate |
Sulfite |