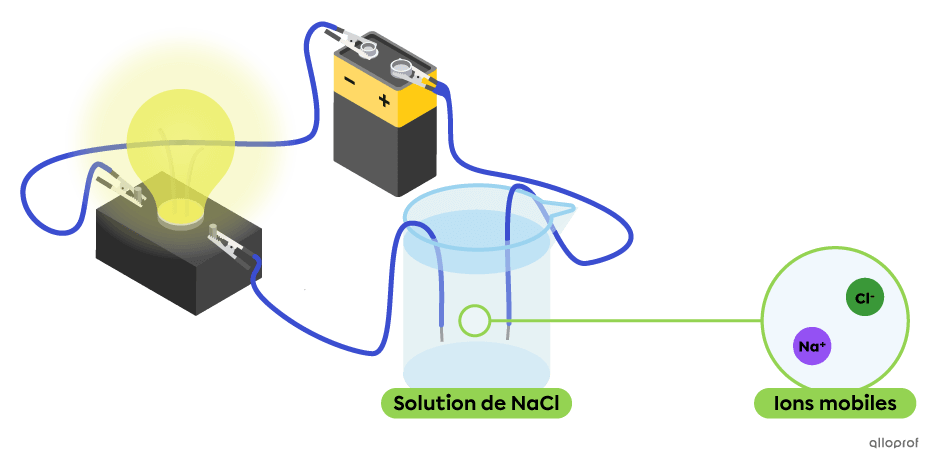
Une solution aqueuse permet le passage d’un courant électrique lorsqu’elle contient des ions mobiles. Ces ions sont obtenus à partir de la dissociation d’un électrolyte dans l’eau. Plus il y a d’ions mobiles, plus la solution est conductrice.
Dans le montage suivant, la solution aqueuse de chlorure de sodium |(\text{NaCl}),| un électrolyte, contient des ions mobiles |\text{Na}^{+}| et |\text{Cl}^{-}.| On observe que cette solution conduit le courant électrique, puisque l’ampoule est allumée.
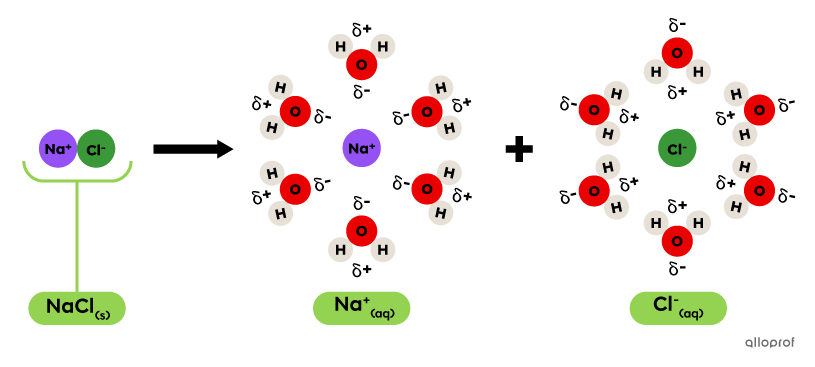
Dans une molécule d’eau |(\text{H}_2\text{O}),| l’oxygène |(\text{O})| a une meilleure tendance à attirer les électrons de la liaison |\text{H-O}| parce que l’oxygène a une plus grande électronégativité que l’hydrogène. Une charge partielle négative se crée près de l’oxygène ainsi qu'une charge partielle positive près des hydrogènes. Ces charges partielles sont représentées par les symboles |\delta^-| et |\delta^+.|
Les charges partielles des molécules d’eau font qu’elles sont attirées vers les particules d’un électrolyte selon une orientation particulière et c’est ce qui lui permet de le dissocier en deux ions.
Dans l’image suivante, voici ce qu’on remarque.
-
L’ion |\text{Na}^+| est entouré par les atomes d’oxygène |(\text{O})| et les symboles |\delta^-| des molécules d’eau. La charge partielle négative de l’eau est attirée par la charge positive du |\text{Na}^+.|
-
L’ion |\text{Cl}^-| est entouré par les atomes d’hydrogène |(\text{H})| et les symboles |\delta^+| des molécules d’eau. La charge partielle positive de l’eau est attirée par la charge négative du |\text{Cl}^-.|
On peut représenter la dissociation d’un électrolyte à l’aide d’une équation chimique où :
-
l’électrolyte est le réactif;
-
le cation et l’anion sont les produits et on les retrouve en phase aqueuse (aq);
-
le cation et l’anion sont accompagnés de leur charge respective;
-
le bilan des charges du cation et de l’anion doit être de |0| (nul).
L'eau |(\text{H}_2\text{O})| n’est généralement pas représentée dans l’équation chimique. C’est l’état aqueux (aq) des produits qui indique qu’il s’agit d’une dissolution dans l’eau.
Voici l’équation chimique de la dissociation électrolytique du chlorure de sodium |(\text{NaCl}).|
||\begin{align}\text{NaCl}_{\text{(s)}}\ \rightarrow \ \text{Na}^{+}{_{\text{(aq)}}}\ +\ \text{Cl}^{-}{_{\text{(aq)}}}\end{align}||
-
|\text{NaCl}_{\text{(s)}}| est l’électrolyte et il est à l’état solide.
-
|\text{Na}{^+}{_{\text{(aq)}}}| est le cation en phase aqueuse et sa charge est de |+1|.
-
|\text{Cl}{^-}{_{\text{(aq)}}}| est l’anion en phase aqueuse et sa charge est de |-1|.
-
En faisant le bilan des charges, on obtient |+1+(-1)=0.|
La démarche suivante permet d’écrire l’équation chimique d’une dissociation électrolytique.
-
Écrire la formule chimique de l’électrolyte, la phase dans laquelle il se trouve en indice du côté des réactifs, puis une flèche vers la droite.
-
Séparer l’électrolyte en son cation et son anion, puis les écrire du côté des produits.
-
À l’aide du tableau périodique, déterminer les charges respectives du cation et de l’anion, puis les écrire en exposant.
-
Écrire la phase aqueuse |\text{(aq)}| des ions en indice.
-
Si la formule chimique de l’électrolyte comprend des indices, ceux-ci deviennent les coefficients des ions.
-
Faire le bilan des charges et s’assurer qu’il est de |0.|
Voici l’équation chimique de la dissociation électrolytique du composé |\text{MgCl}{_2}{_{\text{(s)}}}.|
-
On écrit la formule chimique |\text{MgCl}{_2}| et la phase solide en indice du côté des réactifs, puis on dessine une flèche vers la droite.
|\text{Mg}\text{Cl}{_{2}}{_{\text{(s)}}}\ \rightarrow| -
On sépare |\text{MgCl}{_2}| en un cation et un anion soit |\text{Mg}| et |\text{Cl},| puis on les écrit du côté des produits.
|\text{Mg}\text{Cl}{_{2}}{_{\text{(s)}}}\ \rightarrow \ \text{Mg}\ +\ \text{Cl}| -
À l’aide du tableau périodique, on détermine que l’ion |\text{Mg}| a une charge de |+2| et l’ion |\text{Cl}| a une charge de |-1.| On écrit ces charges en exposant.
|\text{Mg}\text{Cl}{_{2}}{_{\text{(s)}}}\ \rightarrow \ \text{Mg}^{2+}\ +\ \text{Cl}^{-}| -
On indique la phase aqueuse des ions en indice.
|\text{Mg}\text{Cl}{_{2}}{_{\text{(s)}}}\ \rightarrow \ \text{Mg}^{2+}{_{\text{(aq)}}}\ +\ \text{Cl}^{-}{_{\text{(aq)}}}| -
L’indice |2| dans |\text{Cl}_2| devient le coefficient |2| devant l’ion |\text{Cl}^-.|
|\text{Mg}\text{Cl}{_{2}}{_{\text{(s)}}}\ \rightarrow \ \text{Mg}^{2+}{_{\text{(aq)}}}\ +\ 2\ \text{Cl}^{-}{_{\text{(aq)}}}| -
On fait le bilan des charges pour s’assurer qu’il est de |0.|
|\begin{alignat}{1}&\text{Mg}\text{Cl}{_{2}}{_{\text{(s)}}}\ \rightarrow \ &\text{Mg}^{2+}{_{\text{(aq)}}}&\ +\ &2\ \text{Cl}^{-}{_{\text{(aq)}}}\\&&+2&\ +\ &2\times(-1)&\\&&+2&\ +\ &-2&=0\end{alignat}|
L’équation chimique de la dissociation électrolytique du composé |\text{MgCl}{_2}{_{\text{(s)}}}| est |\text{Mg}\text{Cl}{_{2}}{_{\text{(s)}}}\ \rightarrow \ \text{Mg}^{2+}{_{\text{(aq)}}}\ +\ 2\ \text{Cl}^{-}{_{\text{(aq)}}}.|
Détermine l’équation chimique de la dissociation électrolytique du composé |\text{Ca}_{3}\text{N}{_{2}}{_{\text{(s)}}}.|
-
On écrit la formule chimique |\text{Ca}_{3}\text{N}{_{2}}| et la phase solide en indice, puis on dessine une flèche vers la droite.
|\begin{align}\text{Ca}_{3}\text{N}{_{2}}{_{\text{(s)}}}\ \rightarrow\end{align}| -
On sépare |\text{Ca}_{3}\text{N}{_{2}}| en un cation et un anion soit |\text{Ca}| et |\text{N},| puis on les écrit du côté des produits.
|\begin{align}\text{Ca}_{3}\text{N}{_{2}}{_{\text{(s)}}}\ \rightarrow \ \text{Ca}\ +\ \text{N}\end{align}| -
À l’aide du tableau périodique, on détermine que l’ion |\text{Ca}| a une charge de |+2| et l’ion |\text{N}| a une charge de |-3.| On écrit ces charges en exposant.
|\begin{align}\text{Ca}_{3}\text{N}{_{2}}{_{\text{(s)}}}\ \rightarrow \ \text{Ca}^{2+}\ +\ \text{N}^{3-}\end{align}| -
On indique la phase aqueuse des ions en indice.
|\begin{align}\text{Ca}_{3}\text{N}{_{2}}{_{\text{(s)}}}\ \rightarrow \ \text{Ca}^{2+}{_{\text{(aq)}}}\ +\ \text{N}^{3-}{_{\text{(aq)}}}\end{align}| -
L’indice |3| dans |\text{Ca}_{3}| devient le coefficient |3| devant l’ion |\text{Ca}^{2+}| et l’indice |2| dans |\text{N}_{2}| devient le coefficient |2| devant |\text{N}^{3-}.|
|\begin{align}\text{Ca}_{3}\text{N}{_{2}}{_{\text{(s)}}}\ \rightarrow \ 3\ \text{Ca}^{2+}{_{\text{(aq)}}}\ +\ 2\ \text{N}^{3-}{_{\text{(aq)}}}\end{align}| -
On fait le bilan des charges pour s’assurer qu’il est de |0.|
|\begin{alignat}{1}&\text{Ca}_{3}\text{N}{_{2}}{_{\text{(s)}}}\ \rightarrow \ &3\ \text{Ca}^{2+}{_{\text{(aq)}}}&\ +\ &2\ \text{N}^{3-}{_{\text{(aq)}}}\\&&3\times(+2)&\ +\ &2\times(-3)&\\&&+6&\ +\ &-6&=0\end{alignat}|
L’équation chimique de la dissociation électrolytique du composé |\text{Ca}_{3}\text{N}{_{2}}{_{\text{(s)}}}| est |\text{Ca}_{3}\text{N}{_{2}}{_{\text{(s)}}}\ \rightarrow \ 3\ \text{Ca}^{2+}{_{\text{(aq)}}}\ +\ 2\ \text{N}^{3-}{_{\text{(aq)}}}.|
Lorsqu’un électrolyte contient un ou plusieurs ions polyatomiques, on utilise la même démarche pour écrire l’équation de la dissociation. Toutefois, il faut reconnaitre les groupes d’atomes qui forment des ions polyatomiques et connaitre leur charge. Ces informations se trouvent généralement dans un tableau comme celui-ci.
|
Formule chimique |
|\text{CH}_{3}\text{COO}^{-}| |
|\text{NH}_{4}{^{+}}| |
|\text{HCO}_{3}{^{-}}| |
|\text{CO}_{3}{^{2-}}| |
|\text{ClO}_{3}{^{-}}| |
|\text{CrO}_{4}{^{2-}}| |
|\text{H}_{3}\text{O}^{+}| |
|\text{OH}^{-}| |
|\text{NO}_{3}{^{-}}| |
|\text{NO}_{2}{^{-}}| |
|\text{PO}_{4}{^{3-}}| |
|\text{SO}_{4}{^{2-}}| |
|\text{SO}_{3}{^{2-}}| |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Nom |
Acétate |
Ammonium |
Bicarbonate |
Carbonate |
Chlorate |
Chromate |
Hydronium |
Hydroxyde |
Nitrate |
Nitrite |
Phosphate |
Sulfate |
Sulfite |
Détermine l’équation chimique de la dissociation électrolytique du nitrate de sodium solide |(\text{NaNO}_{3}{_{\text{(s)}}}).|
-
On écrit la formule chimique |\text{Na(NO}_{3})| et la phase solide en indice, puis on dessine une flèche vers la droite.
|\text{NaNO}_{3}{_{\text{(s)}}}\ \rightarrow| -
On sépare |\text{NaNO}_{3}| en un cation et un anion soit |\text{Na}| et |\text{NO}{_{3}},| puis on les écrit du côté des produits.
|\text{NaNO}_{3}{_{\text{(s)}}}\ \rightarrow \ \text{Na}\ +\ \text{NO}{_{3}}| -
À l’aide du tableau périodique et du tableau des ions polyatomiques, on détermine que l’ion |\text{Na}| a une charge de |+1| et l’ion polyatomique |\text{NO}{_{3}}| a une charge de |-1.| On écrit ces charges en exposant.
|\text{NaNO}_{3}{_{\text{(s)}}}\ \rightarrow \ \text{Na}^{+}\ +\ \text{NO}{_{3}}^{-}| -
On indique la phase aqueuse des ions en indice.
|\text{NaNO}_{3}{_{\text{(s)}}}\ \rightarrow \ \text{Na}^{+}{_{\text{(aq)}}}\ +\ \text{NO}{_{3}}^{-}{_{\text{(aq)}}}| -
Dans cet exemple, aucun indice de l’électrolyte ne devient le coefficient d’un ion. Le |3| dans |\text{NO}{_{3}}| est compris dans l’ion polyatomique.
-
On fait le bilan des charges pour s’assurer qu’il est de |0.|
|\begin{alignat}{1}&\text{NaNO}_{3}{_{\text{(s)}}}\ \rightarrow \ &\text{Na}^{+}{_{\text{(aq)}}}&\ +\ & \text{NO}{_{3}}^{-}{_{\text{(aq)}}}\\&&+1&\ +\ &-1&=0\end{alignat}|
L’équation chimique de la dissociation électrolytique du composé |\text{Na(NO}_{3}){_{\text{(s)}}}| est |\text{NaNO}_{3}{_{\text{(s)}}}\ \rightarrow \ \text{Na}^{+}{_{\text{(aq)}}}\ +\ \text{NO}{_{3}}^{-}{_{\text{(aq)}}}.|
Détermine l’équation chimique de la dissociation électrolytique du bicarbonate de calcium solide |(\text{Ca(HCO}_{3}){_{2}}{_{\text{(s)}}}).|
-
On écrit la formule chimique |\text{Ca(HCO}_{3}){_{2}}| et la phase solide en indice, puis on dessine une flèche vers la droite.
|\text{Ca(HCO}_{3}){_{2}}{_{\text{(s)}}}\ \rightarrow| -
On sépare |\text{Ca(HCO}_{3}){_{2}}| en un cation et un anion soit |\text{Ca}| et |\text{HCO}{_3},| puis on les écrit du côté des produits.
|\text{Ca(HCO}_{3}){_{2}}{_{\text{(s)}}}\ \rightarrow \ \text{Ca}\ +\ \text{HCO}{_{3}}| -
À l’aide du tableau périodique et du tableau des ions polyatomiques, on détermine que l’ion |\text{Ca}| a une charge de |+2| et l’ion polyatomique |\text{HCO}{_{3}}| a une charge de |-1.| On écrit ces charges en exposant.
|\text{Ca(HCO}_{3}){_{2}}{_{\text{(s)}}}\ \rightarrow \ \text{Ca}^{2+}\ +\ \text{HCO}{_{3}}^{-}| -
On indique la phase aqueuse des ions en indice.
|\text{Ca(HCO}_{3}){_{2}}{_{\text{(s)}}}\ \rightarrow \ \text{Ca}^{2+}{_{\text{(aq)}}}\ +\ \text{HCO}{_{3}}^{-}{_{\text{(aq)}}}| -
L’indice |2| dans |\text{(HCO}_{3}){_{2}}| devient le coefficient |2| devant l’ion polyatomique |\text{HCO}{_{3}}^{-}.|
|\text{Ca(HCO}_{3}){_{2}}{_{\text{(s)}}}\ \rightarrow \ \text{Ca}^{2+}{_{\text{(aq)}}}\ +\ 2\ \text{HCO}{_{3}}^{-}{_{\text{(aq)}}}| -
On fait le bilan des charges pour s’assurer qu’il est de |0.|
|\begin{alignat}{1}&\text{Ca(HCO}_{3}){_{2}}{_{\text{(s)}}}\ \rightarrow \ &\text{Ca}^{2+}{_{\text{(aq)}}}&\ +\ &2\ \text{HCO}{_{3}}^{-}{_{\text{(aq)}}}\\&&+2&\ +\ &2\times(-1)&\\&&+2&\ +\ &-2&=0\end{alignat}|
L’équation chimique de la dissociation électrolytique du composé |\text{Ca(HCO}_{3}){_{2}}{_{\text{(s)}}}| est |\text{Ca(HCO}_{3}){_{2}}{_{\text{(s)}}}\ \rightarrow \ \text{Ca}^{2+}{_{\text{(aq)}}}\ +\ 2\ \text{HCO}{_{3}}^{-}{_{\text{(aq)}}}.|